(I)下图是工业生产硝酸铵的流程。

(1)吸收塔C中通入空气的目的是 。A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:①4NH3(g) + 3O2(g) = 2N2(g) +6H2O(g) △H =-1266.8kJ/mol
② N2(g) + O2(g) = 2NO(g) △H =" +180.5" kJ/mol
写出氨高温催化氧化的热化学方程式:
(II)某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。
(3)该反应的离子方程式为___________________________________________________。
(4)提出合理假设。该实验中反应速率明显加快的原因可能是_____________________。
A.反应放热导致温度升高 B.压强增大
C.生成物有催化作用 D.反应物接触面积增大
(5)初步探究。测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
35 |
50 |
60 |
70 |
80 |
| 温度/℃ |
25 |
26 |
26 |
26 |
26 |
26 |
26.5 |
27 |
27 |
27 |
27 |
结合实验目的和表中数据,你得出的结论是__________________________________。
(6)进一步探究。查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用,请完成以下实验设计表并将实验目的补充完整:
| 实验 编号 |
铜片 质量/g |
0.1mol·L-1的 硝酸体积/mL |
硝酸铜 晶体/g |
亚硝酸钠 晶体/g |
实验目的 |
| ① |
5 |
20 |
_______ |
_______ |
实验①和②探究_________的影响;实验①和③探究亚硝酸根的影响。 |
| ② |
5 |
20 |
0.5 |
0 |
|
| ③ |
5 |
20 |
0 |
0.5 |
磷酸铁(FePO4)为难溶于水的米白色固体,可用于制备药物、食品添加剂和锂离子电池的正极材料。实验室利用钛铁矿(主要成分为FeTiO3,含有少量MgO、CaO、SiO2等杂质)制备磷酸铁和锂离子电池正极材料(LiFePO4)的部分工业流程如图所示:
(1)富钛渣中的主要成分为TiO2和 (填化学式)。煅烧得到LiFePO4的化学方程式为 。
(2)在共沉淀步骤中加入H2O2的目的是让滤液中的Fe2+完全被H2O2氧化。
①反应的离子方程式为 。
②下列实验条件控制正确的是 (填序号)。
| A.加入适当过量的H2O2溶液 | B.缓慢滴加H2O2溶液并搅拌 |
| C.加热,使反应在较高温度下进行 | D.用氨水调节pH=7 |
(3)已知Ca2+、Mg2+和Fe3+离子形成磷酸盐的Ksp分别为2.0×10-29、1.0×10-24和9.9×10-16,若溶液中三种金属阳离子的浓度均为0.1 mol·L-1,则加入H3PO4时首先生成沉淀的化学式为 。
(4)制备LiFePO4的过程中,理论上所需 17%双氧水与H2C2O4·2H2O的质量比为 。
(5)钛铁矿中钛含量的测定步骤为:
①还原。将含钛试样溶解于强酸溶液中,再加入铝片将TiO2+还原为Ti3+,并将Fe3+还原。反应装置如图所示,使用封闭漏斗的目的是 。
②滴定。取下封闭漏斗,向锥形瓶中加入2~3滴KSCN溶液,立即用FeCl3标准溶液滴定至终点,记录读数。
③计算。下列操作会导致测定结果偏低的是 。
a.还原操作结束后铝片有剩余
b.还原操作结束后,反应液仍呈黄色
c.缓慢滴定,且剧烈振荡锥形瓶,但无溶液溅出
化合物KaFeb(C2O4)c·dH2O(其中铁为正三价)是重要的光化学试剂。通过下述实验确定该晶体的组成。
步骤a:称取该样品4.91g溶于水中配成250mL溶液,取出25mL溶液,向其中加入过量的NaOH溶液,将沉淀过滤,洗涤,高温灼烧至质量不再改变,称量其固体的质量为0.08g。
步骤b:另取出25mL溶液,加入适量稀H2SO4溶液,用0.050 mol·L-1KMnO4溶液滴定,到达滴定终点时,消耗KMnO4溶液24.00mL。
已知:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O
(1)草酸(H2C2O4)为二元弱酸,其一级电离的方程式为 。草酸的Ka1约为Ka2的1000倍,可能的原因是 。
(2)滴定终点观察到的现象为 。
(3)通过计算确定样品的组成(写出计算过程)。
化合物F是一种重要的有机合成中间体,它的合成路线如下: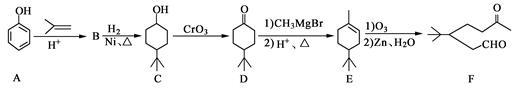
(1)化合物F中含氧官能团的名称是 和 ,由B生成C的化学反应类型是 。
(2)写出化合物C与乙酸反应生成酯的化学方程式: 。
(3)写出化合物B的结构简式: 。
(4)某化合物是D的同分异构体,且分子中只有三种不同化学环境的氢。写出该化合物的结构简式: (任写一种)。
(5)请根据已有知识并结合相关信息,写出以苯酚(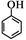 )和CH2=CH2为原料制备有机物
)和CH2=CH2为原料制备有机物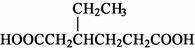 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下: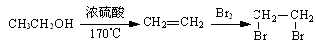
碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述;在基态14C原子中,核外存在 对自旋相反的电子。
(2)CS2分子中,共价键的类型有 。
(3)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253K,沸点为376K,其固体属于 晶体。
(4)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
①在石墨烯晶体中,每个C原子连接3个六元环,每个六元环占有 个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接 个六元环。
现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能 B,元素的电负性由小到大的顺序为一电离能(填“<”“>”或“=”),A、B、C三种元素 (用元素符号表示)。
(2)D元素原子的价电子排布式是 。
(3)C元素的电子排布图为 ;E3+的离子符号为 。
(4)F元素位于元素周期表的 区,其基态原子的电子排布式为 。
(5)G元素可能的性质 。
A.其单质可作为半导体材料 B.其电负性大于磷 C.最高价氧化物对应的水化物是强酸