PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
| |
熔点/℃ |
沸点/℃ |
密度/g·mL-1 |
其他 |
| 黄磷 |
44.1 |
280.5 |
1.82 |
2P(过量)+3Cl2 2PCl3;2P+5Cl2 2PCl3;2P+5Cl2 2PCl5 2PCl5 |
| PCl3 |
—112 |
75.5 |
1.574 |
遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 |
2 |
105.3 |
1.675 |
遇水生成H3PO4和HCl,能溶于PCl3 |
(一)制备:RU 图是实验室制备PCl3的装置(部分仪器已省略)
(1)仪器乙的名称____________。
(2)实验室用漂白粉加浓盐酸制备Cl2的化学方程式:_______________________ 。
(3)碱石灰的作用是____________________。
(4)向仪器甲中通入干燥Cl2之前,应先通入一 段时间的CO2,其目的是____________________。
(二)提纯:
(5)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过_________________(填实验操作名称),即可得到PCl3的纯品。
(三)分析:
测定产品中PCl3纯度的方法如下:迅速称取4.200 g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的0.1000 mol/L 20.00 mL 碘溶液,充分反应后再用0.1000 mol/L Na2S2O3溶液滴定过量的碘,终点时消耗10.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应。
(6)根据上述数据,该产品中PCl3的质量分数为____________________ 。若滴定终点时俯视读数,则PCl3的质量分数_______(偏大、偏小、或无影响)
实验室可用MnO2和KClO3混合加热的方法制取氧气。现有下列仪器或装置:
Ⅰ.(1)A~D装置中,用作KClO3为原料制氧气的反应装置是(填序号);
(2)排水法收集氧气,接口顺序是:氧气出口→→→g→h→烧杯(填序号)。
Ⅱ. KClO3分解时尚有副反应,导致收集到的气体有异味.据推测,副产物可能是O3、Cl2、ClO2中的一种或几种.资料表明:O3、Cl2、ClO2的沸点依次为-111℃、-34℃和11℃,且O3、ClO2也能将KI氧化为I2.为探究副反应气体产物的成分,将KClO3分解产生的气体经干燥后通入下图装置进行实验:
(3)若要确认副产物中含Cl2,F中应盛放溶液。
(4)确定副产物中含有ClO2的现象是。
(5)实验时若D中无现象,E中试纸变蓝,能否得出副产物含有O3的结论?理由是。
Ⅲ.ClO2是饮用水消毒剂.用ClO2处理过的饮用水(pH为5.5~6.5)除含有ClO2外,常含有一定量对人体不利的ClO2-.为测定此饮用水中两者成分,进行如下实验:准确量取VmL水样加入到锥形瓶中,调节水样pH=8,加人足量KI晶体,发生如下反应:2ClO2+2I-═I2+2ClO2-,反应结束后产生amol I2;继续调节溶液pH=1,又发生如下反应:ClO2-+4H++4I-═2I2+Cl-+2H2O,反应结束后叉产生b mol I2。
(6)饮用水中c(ClO2-)=mol•L-1(用含字母的代数式表示)。
为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用(选填序号)。a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g,由此可求算气体Y中SO2的体积分数。
写出探究②中出现的所有离子反应方程式。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。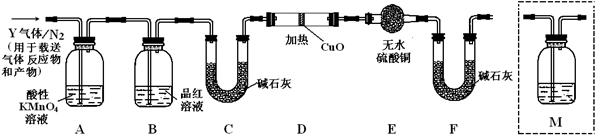
(3)装置B中试剂的作用是。
(4)分析Y气体中的Q2气体是如何生成的。(用化学方程式表示)。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于(选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是。
.硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和 。
(2)为检验分解产物的成份,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
① A中固体充分加热较长时间后,通入氮气,目的是 。
②为验证A中残留物是否含有FeO,需要选用的试剂有 。
| A.KSCN溶液 | B.稀硫酸 |
| C.浓盐酸 | D.KMnO4溶液 |
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有 气体生成,若含有该气体,观察到的现象为 。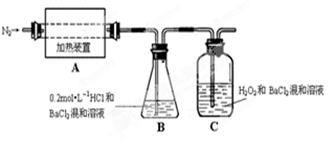
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则b a(填“大于”、“小于”或“等于”)
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为
(用离子方程式表示)。
(3)已知亚铁离子被氧气氧化的反应是:4Fe2+ + O2 + (4+2x) H2O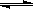 2Fe2O3•xH2O + 8H+,硫酸亚铁铵溶液较硫酸亚铁溶液不易被氧气氧化,其原因是 。
2Fe2O3•xH2O + 8H+,硫酸亚铁铵溶液较硫酸亚铁溶液不易被氧气氧化,其原因是 。
比较法是化学中研究物质性质的基本方法之一,请运用比较法解答下题。Na2O2几乎可与所有的常见气态非金属氧化物反应。如
2Na2O2+2CO2 ="=" 2Na2CO3+O2, Na2O2+CO = Na2CO3。
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式: _________________;___________________。
(2)通过比较可知,当非金属元素处于____________价时,其氧化物与Na2O2反应有O2生成。
(3)依上述规律,写出Na2O2与N2O5反应的化学方程式________________________________。
工业上生产金属钛的方法很多。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O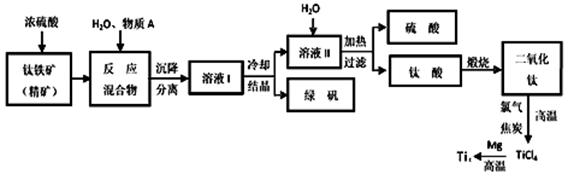
回答下列问题:
(1)钛铁矿和浓硫酸反应属于_________(选填“氧化还原反应”或“非氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是________,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是__________、___________。
(3)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是_____________________。
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2 (s)+ 2Cl2 (g) +2C(s) =TiCl4(g) + 2CO(g)
ΔH1 = -72 kJ•mol-1TiO2(s) + 2Cl2 (g) =TiCl4(g) + O2 (g)
ΔH2 =+38.8kJ•mol-1
C(s)+CO2(g)=2CO(g) ΔH3 =+282.8kJ•mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行
的原因是______________________。
②反应C(s)+O2(g)=CO2 (g)的ΔH=_______________。
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO
作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。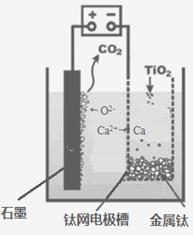
①写出阳极所发生反应的电极反应式:_______________________。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释)_________。