醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下: ① NaBr+H2SO4 = HBr+NaHSO4;②R-OH+HBr R-Br+H2O
R-Br+H2O
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下
| |
乙醇 |
溴乙烷 |
正丁醇 |
1-溴丁烷 |
| 密度/g·cm-3 |
0.7893 |
1.4604 |
0.8098 |
1.2758 |
| 沸点/℃ |
78.5 |
38.4 |
117.2 |
101.6 |
请回答下列问题:
(1)溴代烃的水溶性 (填“大于”、“等于”或“小于”)相应的醇;其原因是 。
(2)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在 (填“上层”、“下层”或“不分层”)。
(3)制备操作中,加入的浓硫酸必须进行稀释,目的是 。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是 。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于 ;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是 。
丁烷的分子结构可简写成键线式结构 ,有机物A的键线式结构为
,有机物A的键线式结构为 ,有机物B与等物质的量的H2发生加成反应可得到有机物A。则:
,有机物B与等物质的量的H2发生加成反应可得到有机物A。则:
(1)有机物A的分子式为。
(2)用系统命名法命名有机物A,其名称为。
(3)有机物B可能的结构简式为:、、。
实验室用无水酒精和浓硫酸以1∶3的体积比混合加热制乙烯气体,请填写下列空白:
(1)写出制取乙烯的化学反应方程式_________。
(2)温度在170℃以上会使乙醇炭化,接着能发生氧化还原反应,生成二氧化碳、二氧化硫气体和水。试写出该反应的化学方程式。
(3)实验后期制得的乙烯气体中常含有杂质气体,将此混合气体直接通入溴水中能否证明乙烯发生加成反应的性质?__________(填“能“或“否”),原因是______________
。
(4)实验室制备乙烯所用浓硫酸主要作用是________。所用温度计水银球的位置是__________________。
请认真运算,并将正确答案填写在空白处。(不得使用计算器)
(1)恒温下,向pH = 6的蒸馏水中加入2.3 g金属钠充分反应后,再加蒸馏水稀释至1L,所得溶液的pH =
(2)常温下,pH = 5的稀H2SO4溶液稀释1000倍,则稀释后溶液中 的比值为
的比值为
(3)25℃,在等体积的①pH=0的H2SO4溶液②0.05 mol/L的Ba(OH)2溶液③pH=10的K2S溶液④pH=5的NH4NO3溶液中发生电离的水的物质的量之比为
(4)当NH3·H2O和盐酸混合恰好中和成c mol/L的NH4Cl稀溶液,试用c、c(H+)及氨水的Kb值、水的Kw值表示该溶液中 的平衡浓度,c(
的平衡浓度,c( )平=
)平=
由短周期元素组成的A、B两种盐可发生下列变化,且B的焰色反应呈黄色。(图中其它生产物未列出)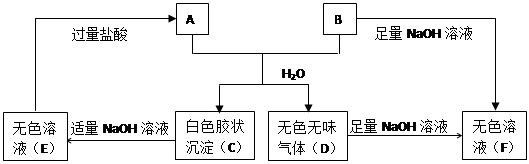
(1)无色溶液(F)中,一定含有的溶质的化学式为
(2)写出白色胶状沉淀C转化为无色溶液E的化学方程式
(3)A、E两溶液混合反应时,可观察到的现象是,写出其反应的离子方程式
(4)A和B的混合物溶于水发生反应的离子方程式
以下各题中各量的关系,请用“﹥”、“=”或“﹤”表示。
(1)pH = 3的醋酸和pH=11的氢氧化钠溶液等体积混合,混合液中c(Na+) c(CH3COO-)
(2)等物质的量浓度、等体积盐酸和醋酸钠混合,混合液中各离子浓度的大小关系为
(3)常温下,若NaOH溶液中的c(OH-)与NH4Cl溶液中的c(H+)相同。现将NaOH和NH4Cl的溶液分别稀释10倍,稀释后NaOH和NH4Cl溶液的pH分别用pH1和pH2表示。则pH1+ pH214
(4)现有pH相等、等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液均呈中性,则V1 、V2 、V3的大小关系