向22.4g的Fe2O3、Cu的混合物中加入0.5mol/L的硫酸溶液600mL时,固体恰好完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
| A.6.4g | B.4.8g | C.2.4g | D.1.6g |
化学在生产和日常生活中有着重要的应用。下列说法正确是
| A.汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 |
| B.向煤中加入适量石灰石,使煤燃烧产生的SO2最终生成CaSO3,可减少对大气的污染 |
| C.高纯度的硅单质广泛用于制作光导纤维 |
| D.大量燃烧化石燃料排放的废气中含CO2、SO2,从而使雨水的pH=5.6形成酸雨 |
某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32- 、SO42-。现取该溶液进行有关实验,实验结果如下图所示:
下列说法正确的是
| A.沉淀甲可能是AgBr |
| B.沉淀丙一定是BaCO3 |
| C.气体甲的成份只有4种可能 |
| D.肯定存在的离子有AlO2-、S2-、SO32-、Na+ |
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成甲、乙两份。向甲中逐渐加入铜粉,最多能溶解9.6g铜粉。向乙中逐渐加入铁粉,最多能溶解14.0g铁粉。 (假设硝酸只被还原为NO气体)。下列分析或结果错误的是
| A.原混合酸中NO3—物质的量为0.1 mol |
| B.乙中最多产生气体是0.2mol |
| C.原混合酸中HNO3浓度为1.0 mol·L-1 |
| D.原混合酸中H2SO4浓度为2.5 mol·L-1 |
下列说法正确的是
| A.水比硫化氢稳定的原因是水分子间存在氢键 |
| B.升高NH4Cl溶液温度,其水的离子积常数和pH均增大 |
| C.实验中需用0.20 mol·L-1的NaOH溶液950mL,配制时应称取NaOH的质量8.0g |
| D.相同浓度和体积的NaCl溶液与NaHCO3溶液中离子总数NaCl<NaHCO3 |
电化学降解NO3-的原理如图所示。下列说法正确的是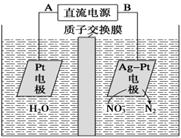
| A.电源正极为B |
| B.阳极反应式为2NO3-+6H2O+10e-= N2↑+12OH- |
| C.当产生N211.2L时,电路中通过的电子数为5NA |
| D.若电解过程中转移了2 mol电子,则两极产生的气体的质量差为10.4g |