下列图示与对应的叙述不相符的是 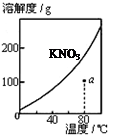
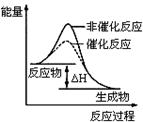
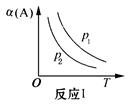
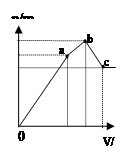
图1 图2 图3 图4
| A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
C.图3表示反应aA(g)+bB(g)  cC(g)表示改变某一条件对化学平衡的影响, 若p1>p2此反应自发进行,必须满足的条件是低温 cC(g)表示改变某一条件对化学平衡的影响, 若p1>p2此反应自发进行,必须满足的条件是低温 |
| D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化 |
一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g) C(g)+D(l),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量 ④B的物质的量浓度
C(g)+D(l),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量 ④B的物质的量浓度
| A.①②④ | B.②③ | C.②③④ | D.只有④ |
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
| A.t2时加入了催化剂 | B.t3时降低了温度 |
| C.t5时增大了压强 | D.t4~t5时间内转化率一定最低 |
在容积不变的密闭容器中,在一定条件下发生反应:2A(?) B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是
B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是
| A.若正反应为吸热反应,则A为非气态 |
| B.若正反应为放热反应,则A为气态 |
| C.若在平衡体系中加入少量C,则该平衡不移动 |
| D.压强对该平衡的移动无影响 |
下列各条件下发生反应X+Y=XY时,速率最快的是
| A.常温下,20mL中含X、Y各0.003mol的溶液 |
| B.常温下,100mL中含X、Y各0.005mol的溶液 |
| C.常温下,0.1mol/L的X、Y溶液各l0mL相混合 |
| D.标准状况下,0.1mol/L的X、Y溶液各l0mL相混合 |
下列电离方程式书写正确的是
| A.NaHSO4=Na++H++SO42- | B.NaHCO3=Na++H++CO32- |
| C.CH3COOH=CH3COO-+H+ | D.H2CO3⇌2H++CO32- |