工业制硝酸的主要反应是:4NH3(g)+5O2(g) 4NO(g)+6H2O (g) ΔH=" -1025" KJ/mol
4NO(g)+6H2O (g) ΔH=" -1025" KJ/mol
(1)一定温度下,现将0.8mol NH3和1.5mol O2充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 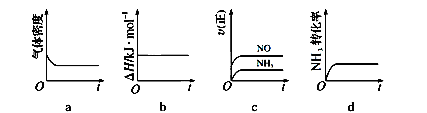
(2)在容积为1L的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 |
c(NH3)(mol/L) |
C(O2)(mol/L) |
C(NO)(mol/L) |
| 起始 |
0.8 |
1.5 |
0 |
| 第2min |
0.7 |
a |
0.1 |
| 第4min |
0.4 |
1.0 |
0.4 |
| 第6min |
0.4 |
1.0 |
0.4 |
| 第8min |
1.2 |
2.5 |
0.4 |
①起始时物料比c (O2) : c (NH3)>1.25,其原因是
②反应在第2min到第4min时O2的平均反应速率为 mol·L-1·min-1
③反应在第2min改变了反应条件,改变的条件可能是 (填字母序号)
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是 ,再次达到平衡时,NO的体积分数
(填“增大”、“减小”或“不变”)
黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]不溶于水和稀硫酸,制取黄钾铵铁矾的流程如下: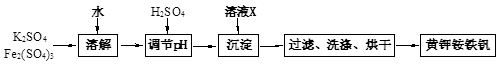
(1)溶液X是。
(2)检验滤液中是否存在K+的操作是。
(3)黄钾铵铁矾的化学式可通过下列实验测定:
①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体224mL,同时有红褐色沉淀生成。
④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算确定黄钾铵铁矾的化学式(写出计算过程)。
钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。
(1)酸浸时发生的反应的离子方程式为;为提高BaCO3的酸浸率,可采取的措施为(任答一点)。
(2)配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,目的是。
(3)加入H2C2O4溶液时,发生反应的化学方程式为;
可循环使用的物质X是。
(4)煅烧得到BaTiO3的同时,生成高温下的气体产物有CO、和。
[物质结构与性质]乙烯酮 (CH2=C=O)是一种重要的有机中间体,可由C2H2和O2的混合气体通过锌、钙、银的三种金属的氧化物(催化剂)反应得到。也可用CH3COOH在痕量(C2H5O)3P=O存在下加热脱H2O得到。
(1)Zn2+基态核外电子排布式为。
(2)与H2O互为等电子体的一种阴离子为;乙烯酮分子中碳原子杂化轨道类型有。
(3)CH3COOH的沸点比HCOOCH3的高,其主要原因是。
(4)lmol(C2H5O)3P=O分子中含有的 键的数目为。
键的数目为。
(5)Ag的氧化物的晶胞结构如图所示,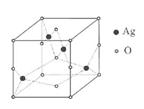
该氧化物的化学式为 .
(14分)二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业。
(1)国外学者提出的由CO2制取C的太阳能工艺如图所示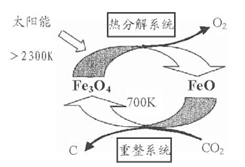
①“热分解系统”发生的反应为2Fe3O4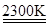 6FeO+O2↑,每分解lmolFe3O4转移电子的物质的量为。
6FeO+O2↑,每分解lmolFe3O4转移电子的物质的量为。
②“重整系统”发生反应的化学方程式为。
(2)二氧化碳催化加氢合成低碳烯烃是目前研究的热门课题,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)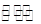 C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示: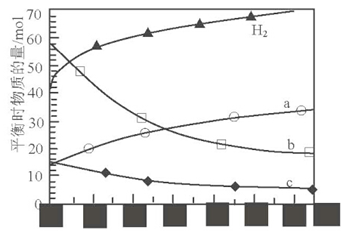
①曲线b表示的物质为 (写化学式)。
②该反应的△H 0(填:“>” 或“<”)
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是(列举l项)。
(3)据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图所示。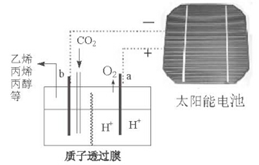
①该工艺中能量转化方式主要有(写出其中两种形式即可)。
②电解时其中b极上生成乙烯的电极反应式为。
(12分)氧化锌是重要的基础化工原料,从含锌废水(含Zn2+及少量的Mn2+、Fe2+及Pb2+等)为原料制取ZnO的实验流程如下: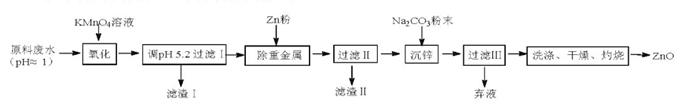
已知几种难溶氢氧化物沉淀的PH范围
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Pb(OH)2 |
| pH |
2.2~3.2 |
5.8~7.9 |
5.5~13.5 |
7.0~13.0 |
(1)KMnO4氧化废水中Mn2+生成MnO2的离子方程式为;滤渣I的主要成分除MnO2外,另一种
是(写化学式)。
(2)滤渣II的主要成分除过量的Zn粉、MnO2外,还有(写化学式);滤渣II中含有二氧化锰,其可能原因是。
(3)灼烧生成的碱式碳酸锌[ZnCO3·2Zn(OH)2]的化学方程式为 ;灼烧时,用到的硅酸盐质仪器除酒精灯外还用到的2种是。