氨气是一种重要的化工产品,是生产铵盐、尿素等的原料。工业合成氨的反应如下:N2(g) +3H2(g)  2NH3(g) △H=一92. 4 KJ·mol-1
2NH3(g) △H=一92. 4 KJ·mol-1
(1)2NH3(g)  N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
①单位时间内生成3n mol H2:同时生成2n mol NH3②用NH3、N2、H2表示反应速率比为2∶1∶3 ③混合气体的密度不再改变 ④混合气体压强不再改变 ⑤混合气体平均相对分子质量不再改变
| A.①③④ | B.①②④⑤ | C.①④⑤ | D.②③④ |
(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2]。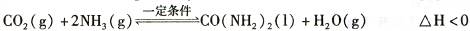
t℃时,向容积恒定为2L的密闭容器中加入0.10 molCO:和0. 40 molNH3 ,70 min开始达到平衡。反应中CO2 ( g)的物质的量随时间变化如下表所示:
| 时间/min |
0 |
30 |
70 |
80 |
100 |
| n(CO2) /mol |
0.10 |
0.060 |
0.040 |
0.040 |
0.040 |
①20 min时,υ正(CO2 )_ 80 min时。υ逆(H2O)(填“>”、“=”或“<”)。
②在100 min时,保持其它条件不变,再向容器中充入0. 050 mo1CO2和0. 20 molNH3,重新建立平衡后CO2的转化率与原平衡相比将_ (填“增大”、“不变”或“减小”)。
③上述可逆反应的平衡常数为_ (保留二位小数)。
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图像;保持其它条件不变;则(t+10)℃下正确的图像可能是 (填图甲中的“A”或“B”)。
⑤图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气。该装置中阳极的电极反应式为 ,若两极共收集到气体22. 4L(标
况),则消耗的尿素为 g(忽略气体的溶解)。
一定温度下,有a.盐酸;b.硫酸;c.醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是___________________,
②同体积同物质的量浓度的三种酸,中和NaOH能力由大到小的顺序是__________,
③当其c(H+)相同时,物质的量浓度由大到小的顺序为_____________________,
④当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的顺序为______________________。
⑤当c(H+)相同、体积相同时,同时加入形状、质量、密度相同的锌,若产生相同体积的氢气(相同状况),则开始时反应速率的大小关系是__________________,反应所需的时间的长短关系是__________________。
⑥将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为_____________。
(10分,每空2分)在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)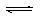 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题: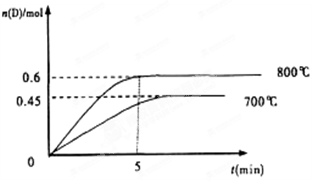
(1)800℃时。0—5min内,以B表示的平均反应速率为。
(2)能判断该反应达到化学平衡状态的依据是。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=,该反应为反应(填吸热或放热)
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol, n(C)=0.9mol,n(D)=0.9mol,则此时该反应进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
在化学反应中,只有少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应。我们把能引发化学反应的碰撞称为有效碰撞,发生有效碰撞的分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ•mol-1表示。认真观察右图,然后回答问题。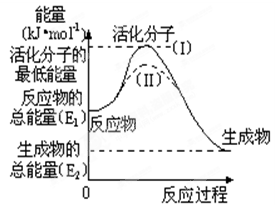
(1)图中反应是(填“吸热”或“放热”)反应,该反应的△H=kJ•mol-1(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+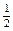 O2(g) =H2O(g)△H=-241.8kJ•mol-1,该反应的活化能为167.2 kJ•mol-1,则逆反应的活化能为。
O2(g) =H2O(g)△H=-241.8kJ•mol-1,该反应的活化能为167.2 kJ•mol-1,则逆反应的活化能为。
(3)对于同一反应,图中虚线( Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是。
Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是。
写出下列物质在水溶液中的电离方程式。
(1) NaCl:
(2)H2CO3:
(3)KHCO3:
(4)NaHSO4:
海水是一种重要的自然资源。以下是我市对海水资源的部分利用。
(1)从海水中获得氯化钠。将海水进行可得到粗盐;为除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤。正确的操作顺序是_________________。(用序号填一种合理组合)。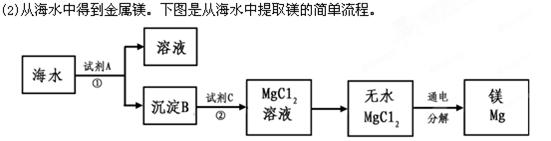 上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,
由无水MgCl2制取Mg的化学方程式为_____________________________________。海
水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:___________________________________________________________。