过氧化物是一类非常重要的化合物,从人们制得第一种过氧化物距今已有200多年的历史了,在众多的过氧化物中过氧化氢迄今为止仍然得到广泛的应用。
(1)与H2O2具有相同的电子总数的双原子分子有 (写两种);
(2)若从海水中提取碘,需将碘化物变成单质碘。写出在酸性条件下H2O2氧化I—离子的离子方程式 ;
(3)Na2O2、K2O2、CaO2和BaO2都能与酸作用生成H2O2,目前实验室制取H2O2可通过上述某种过氧化物与适量的稀H2SO4作用并过滤后获得,其中最适合的过氧化物是 (填化学式);
(4)纯H2O2可用作火箭燃料的氧化剂,已知0.4mol液态肼(N2H4)与足量的液态H2O2反应,生成N2(g)和H2O(g),放出256.6kJ的热量,则该反应的热化学方程式是 。
反应A(g)+B(g)  C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是____________________反应(填“吸热”、“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”、“减小”或“不变”),原因是___________________________________________________________________;
(3)反应体系中加入催化剂对反应热是否有影响?________,原因是__________________________________________________________________________________________;
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2 ________(填“增大”、“减小”或“不变”)。
某工业残渣主要成分为Fe2O3。(含有少量FeO、Cu、Mg等杂质)某课外兴趣小组利用该残渣制取Fe2O3粉末的实验流程如下:(说明流程中向黄色溶液中加入MgO的目的是调节溶液的酸碱性,使Fe3+生成沉淀而Mg2+不沉淀。)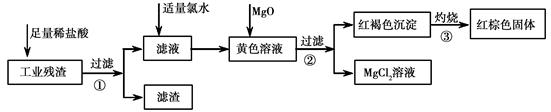
请回答下列问题:
(1)加入足量稀盐酸后,发生化学反应的类型有_____________(填写代号)。
| A.置换反应 | B.化合反应 | C.分解反应 | D.复分解反应E.氧化还原反应 |
(2)加入适量氯水的作用是;
(3)写出灼烧红褐色沉淀时发生反应的化学方程式。实验室灼烧红褐色沉淀可选用的装置是__________(填序号)。
(4)若向黄色溶液中加入过滤①后的滤渣发生反应的离子方程式为。
(5)检验黄色溶液中Fe3+是否完全沉淀的方法是:取过滤②后的少量滤液于试管中,。(请补充完整实验操作、现象、结论)
(16分)氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究Cl2的漂白性。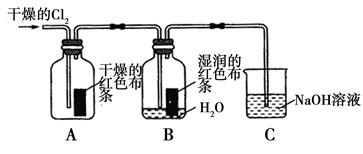
①通入Cl2后,观察到的现象是根据现象可得出的结论是______。
②集气瓶B发生反应的离子方程式是______。
③C装置的作用是______,若有2.24 L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子数为________mol。
(2)兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。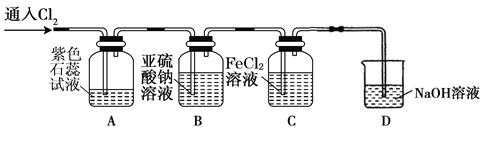
①实验开始后,观察装置A中的现象是:。
②装置C中发生反应的离子方程式是。
③停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2时装置B中发生反应的离子方程式是。
(14分)研究钠及其化合物有重要意义。
(1)NaOH是实验室中最常用的试剂之一。实验室进行某实验需要0.5 mol·L-1的氢氧化钠溶液约480 mL,根据溶液配制的过程,回答下列问题:
①实验除了需要托盘天平(带砝码)、药匙、烧杯和玻璃棒外,还需要的其他玻璃仪器是。
②根据计算得知,需用托盘天平(带砝码)准确称量NaOH固体 g。
(2)Na2O2可作为呼吸面具和潜水艇里氧气的。Na2O2作为供氧剂时可能发生的反应有、。
(3)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应: 2NaNO2+4HI===2NO↑+I2+2NaI+2H2O
①上述反应中,氧化剂是________。每生成标准状况下的NO气体2.24L,反应中被氧化的HI 的物质的量是mol。
②某厂废切削液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________。
| A.NaCl | B.NH4Cl | C.HNO3 | D.浓硫酸 |
(12分)某无色溶液中可能含有Na+、Ba2+、Cu2+、CO32-、Cl-、Mg2+中的一种或几种离子。
①向此溶液中滴加足量稀盐酸无明显现象。
②取少许①的溶液并加入少量的Na2SO4溶液,有白色沉淀产生。
③取②的上层清液并加入足量的NaOH溶液,有白色沉淀产生。
(1)原溶液中一定含有的离子是________,一定不含有的离子是________,不能确定是否含有的离子是________。
(2)②中反应的离子方程式为。
(3)若另取10mL①的溶液于锥形瓶中,然后向此溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
①OA段反应的离子方程式为。
②AB段反应的离子方程式为。