CuSO4是一种重要的化工原料,其有关制备途径如图所示。下列说法不正确的是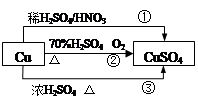
(已知:2Cu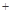 O2
O2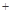 2H2SO4=2CuSO4
2H2SO4=2CuSO4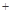 2H2O)
2H2O)
| A.相对于途径①、③,途径②更好地体现了绿色化学思想 |
| B.途径③中,1mol Cu与足量浓硫酸反应会产生64g SO2气体 |
C.途径①所用混酸中H2SO4与HNO3物质的量之比最好为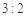 |
D.1mol Cu分别按照途径②、③中,被还原的H2SO4的质量之比为 |
一定条件下,在固定容积的密闭容器中,能表示反应X(g)+2Y(g)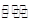 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1∶2∶2②X、Y、Z的浓度不再发生变化
③容器中气体的压强不再发生变化④单位时间内生成n mol Z,同时生成n mol X
| A.①② | B.①④ | C.②③ | D.③④ |
《化学反应原理》模块从不同的视角对化学反应进行了探究、分析。以下观点中不正确的是
①放热反应在常温下均能自发进行;②电解过程中,化学能转化为电能而“储存”起来;
③原电池工作时所发生的反应一定有氧化还原反应;④加热时,化学反应只向吸热反应方向进行;
⑤盐类均能发生水解反应;⑥化学平衡常数的表达式与化学反应方程式的书写无关。
| A.①②④⑤⑥ | B.①④⑤⑥ | C.②③⑤⑥ | D.①②④⑤ |
已知温度T时水的离子积常数为KW,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
| A.a=b |
| B.混合溶液的PH=7 |
C.混合溶液中,c(H+)=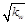 mol·L-1 mol·L-1 |
| D.混合溶液中,c(H+)+ c(B+)= c(OH-)+ c(A-) |
下列实验操作正确的是
| A.用pH试纸测得某新制氯水的pH值为3.5 |
| B.电解法精炼铜,将粗铜接电源的正极 |
| C.将氯化铁晶体溶于蒸馏水中,配制氯化铁溶液 |
| D.将氯化铁溶液加热蒸干,再灼烧,就得到氯化铁晶体 |
下列与化学反应能量变化相关的叙述正确的是
| A.生成物能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.应用盖斯定律,可计算某些难以测定的反应焓变 |
D.同温同压下, 在光照和点燃条件的 在光照和点燃条件的 不同 不同 |