Ⅰ.实验室有一瓶澄清的溶液,实验人员确定其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-,取该溶液进行下列实验:
①取pH试纸检验,表明溶液呈强酸性。
②取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色。
③另取部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生。
④取部分上述碱性溶液加Na2CO3溶液,有白色沉淀生成。
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
⑥向②的水层中加入HNO3酸化的AgNO3溶液有白色沉淀。
根据上述实验事实确定,请你判断该溶液中
(1)肯定存在的离子是 ;
(2)不能确定是否存在的离子是 。
Ⅱ. 二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式 。
(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O→Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是 。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+ 4KI+ 4HNO3→Se+2I2+ 4KNO3+2H2O ②I2+2Na2S2O3→Na2S4O6+2NaI
实验中,准确称量SeO2样品0.1500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为 。
碳酸钙和硫酸钙都是钙的重要化合物,它们在生产生活中都有着广泛的应用。甲、乙两组同学分别对碳酸钙的制备、硫酸钙的性质进行了以下探究,请你参与并完成对有关问题的解答。
(1)甲组使用大理石(含少量的Fe2O3杂质)等物质制备碳酸钙的实验流程如下:
①溶解大理石时,用硝酸而不用硫酸的原因是。
②上述流程中,“分离”得产品所包含的实验操作依次为:过滤、、。
③“滤液A”中除H+离子外,还含有的阳离子是;检验该阳离子的实验方法是:取少量滤液A与在试管中混合、加热充分反应,将湿润的红色石蕊试纸(或pH试纸)靠近试管口,观察现象即可。
(2)乙组对某硫酸钙晶体(xCaS04·yH20)加热分解的有关反应进行探究。他们取6.52g该晶体进行加热,加热过程中,固体质量随时间的变化情况如下图所示。又知t5~t6时间段内固体质量减轻的原因是产生了两种气体,反应的化学方程式为:2CasO4 2CaO+2S02↑+O2↑。
2CaO+2S02↑+O2↑。
①加热时,该晶体开始发生化学变化的时间是(填“t1”、“t3”或“t5”)。
②t4~t5时间段固体的化学式为。
③tl~t2时间段固体发生反应的化学方程式为。
下图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去。常温常压下,化合物A是家庭生活中常用的一种调味品,A、C的焰色反应都呈黄色,B是无色无味的液体,D是黄绿色气体,E、F都是无色气体,F的水溶液是盐酸,H的水溶液具有漂白、杀菌性,J在水溶液中生成时为红褐色沉淀。
(1)H的化学式为。
(2)F的电子式为。
(3)反应①的化学方程式为。
(4)反应②的离子方程式为。
化学和环境保护、食品营养、材料应用等密切相关。
(1)防治环境污染、改善生态环境已成为全人类的共识。
①下列各项中,完成空气质量报告时不需要监测的是(填字母)。
A.可吸入颗粒物的浓度
B.二氧化氮的浓度
C.二氧化碳的浓度
②下列做法中不利于改善环境质量的是(填字母)。
A.将废旧电池进行深埋处理
B.充分利用太阳能等清洁能源
C.给汽车加装尾气催化净化装置
③工业废水需处理达标后才能排放。轧钢厂排出的废水主要是含盐酸的酸性废水,处理此废水可采用的方法是(填字母)。
A.沉淀法 B.中和法C.氧化还原法
(2)营养平衡、合理用药是保证人体健康和生活质量的重要途径。
①人体需要的营养素主要有糖类、、蛋白质、无机盐、维生素和水。在氢、钠、铁这三种元素中,属于人体生命活动必需微量元素的是。
②下列物质中,具有解热镇痛疗效的是(填字母)。
A.氨基酸B.阿斯匹林 C.青霉素
③有些药片常用淀粉作为黏合剂,淀粉进入人体后在人体内酶的催化作用下逐步水解,最终转化为(填物质的名称)。维生素C能防治坏血病并具有还原性,验证维生素C有还原性可以使用淀粉溶液和试剂共同完成。
(3))材料是人类社会发展的物质基础,材料科学的发展离不开化学。
①陶瓷、水泥和普通玻璃都是生活中最常见的材料,它们属于(填字母)。
A.金属材料 B.无机非金属材料 C.有机高分子材料
制造普通玻璃时,需要的主要原料有纯碱、石灰石和(填化学式)。
②钢铁制品在潮湿的空气中发生(填“化学”或“电化学”)腐蚀是造成钢铁腐蚀的主要原因。硬铝(一种铝合金)是制造飞机和宇宙飞船的理想材料,和纯铝相比,硬铝的强度(填“低”、“高”或“无法确定”),具有较强的抗腐蚀能力。
③在尼龙、棉花、涤纶这三种物质中,属于天然纤维的是。橡胶是制造轮胎的重要原料,天然橡胶通过(填“硫化”、“氧化”或“老化”)措施可增大其强度、弹性和化学稳定性等。“白色污染”已成为当今社会的一大公害,“白色污染”主要是(填“废塑料制品”、“废橡胶制品”或“生活垃圾”)造成的。
在常温下向20mL 0.1 mol·L-1某酸(用HAc表示)溶液中逐滴加入0.1 mol·L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化)。请根据表中数据和滴定曲线回答以下问题:
| V(NaOH)mL |
0.00 |
10.00 |
18.00 |
19.80 |
19.98 |
20.00 |
20.02 |
20.20 |
22.00 |
40.00 |
| pH |
3.0 |
4.7 |
5.7 |
6.7 |
7.7 |
8.7 |
9.7 |
10.7 |
11.7 |
12.5 |
(1)实验中的指示剂最好使用___________________________;
(2)当V (NaOH)=20.00mL时,请写出溶液中主要存在的两种平衡状态的表示式_______________、________________;溶液中离子浓度由大到小的顺序是___________________;
(3)a、b、c、d四点对应溶液中水的电离程度由大到小的顺序是_________________。
(4)该温度下,滴定曲线上c点时HAc的电离平衡常数Ka=_______(用含V的代数简式表示)。
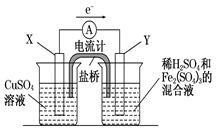
金属铜不溶于稀硫酸,但可溶于铁盐溶液。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)。
(1)写出铜溶解于上述混合溶液的离子方程式_______________________________________。
(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是_________g,溶液中的c(SO42—)=__________mol/L。
(3)若欲在如图所示的装置中发生(1)中的反应,则:X极是(正、负极),电极反应式。Y极的材料是,电极反应式。