【有机化学基础】
用甲苯生产一种常用的化妆品防霉剂,其生产过程如图(反应条件没有全部注明).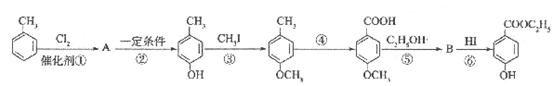
根据转化图填空
(1)有机物A的结构简式_____________
(2)在合成路线中,设计第③步反应的目的是:__________________________.
(3)写出反应⑤的化学方程式__________________________________________.
(4)请写出由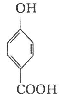 生成C7H5O3Na的化学反应方程式______________________________.
生成C7H5O3Na的化学反应方程式______________________________.
(5)下列有关说法正确的是_____________。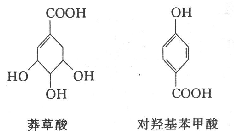
A.莽草酸、对羟基苯甲酸都属于芳香族化合物
b.1 mol莽草酸与NaOH溶液反应,最多消耗4 molNaOH
c.二者均可以发生酯化、氧化、加成等反应
d.利用FeCl3溶液可区别莽草酸和对羟基苯甲酸
(6)写出同时符合下列要求的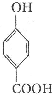 所有同分异构体的结构简式_____________.
所有同分异构体的结构简式_____________.
A.含苯环
b.可与FeCl3溶液发生显色反应
c.一氯代物有两种
d.能发生银镜反应,不能发生水解反应。
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g),△H=-a kJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①能说明该反应已达平衡状态的是________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②计算该温度下此反应的平衡常数K=_________。(保留两位有效数字)。若改变条件(填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为:。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:①CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
②CH3OH(g)=CH3OH(l)△H=-b kJ·mol-1;
③2H2(g)+O2(g)=2H2O(g)△H=-c kJ·mol-1;
④H2O(g)=H2O(l)△H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_____________________________
铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料。
(1)铝元素在元素周期表中的位置是。
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
①该电池的总反应化学方程式为;
②电池中NaCl的作用是。
③以铝一空气电池为电源电解KI溶液制取KIO3(石墨为电极材料)时,电解过程中阳极的电极反应式为。
④某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为
(3)氯化铝广泛用于有机合成和石油工业的催化剂,聚氯化铝也被用于城市污水处理。
①氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为。
②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式。
软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下: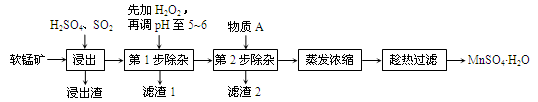
已知:Fe3+、Al3+、Mn2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、10.4、12.4;温度高于27℃时,MnSO4的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为________。
(2)“浸出”过程中Fe2O3转化为Fe3+和Fe2+,相关反应的离子方程式为________。
(3)“滤渣1”的主要成分是__________,“调pH至5~6”所加的试剂是_________(填“石灰水”或“稀硫酸”)。
(4)根据下表数据,选择“第2步除杂”所加的物质A(由一种阳离子和一种阴离子组成),物质A的化学式为________。
 阴离子 阴离子Ksp  阳离子 |
CO32- |
F- |
OH- |
| Ca2+ |
5.0×10-9 |
1.5×10-10 |
4.7×10-6 |
| Mg2+ |
3.8×10-6 |
7.4×10-11 |
5.6×10-12 |
| Mn2+ |
2.2×10-11 |
5.3×10-3 |
2.1×10-13 |
| Zn2+ |
1.2×10-10 |
3.0×10-2 |
6.9×10-17 |
(5)采用“趁热过滤”操作的原因是________。
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是
反应①:CH4(g)+ H2O(g)  CO(g) + 3H2(g) ΔH > 0
CO(g) + 3H2(g) ΔH > 0
(1)已知:
CH4(g)+ 2O2(g) = CO2(g) + 2H2O(g)ΔH1= -802 kJ·mol-1
CO(g) + 1/2O2(g) = CO2(g)ΔH2 = -283 kJ·mol-1
H2(g) + 1/2O2(g) = H2O(g)ΔH3 = -242 kJ·mol-1
则反应①的ΔH =_________(用ΔH1、ΔH2和ΔH3表示)。
(2)其他条件相同,反应①在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CH4的转化率随反应温度的变化如图所示。
①在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是________。
②a点所代表的状态________(填“是”或“不是”)平衡状态。
③c点CH4的转化率高于b点,原因是________。
(3)反应①在恒容密闭反应器中进行,CH4和H2O的起始物质的量之比为1︰2,10 h后CH4的转化率为80%,并测得c(H2O)=0.132 mol·L-1,计算0~10 h内消耗CH4的平均反应速率_____(写出计算过程,结果保留2位有效数字)。
(4)在答题卡的坐标图中,画出反应①分别在700℃和850℃下进行时,CH4的转化率随时间t变化的示意图(进行必要标注)。
羰基化反应是制备不饱和酯的有效途径,如:
反应①:
化合物I可由化合物Ⅲ合成:
(1)化合物Ⅱ的分子式为________,化合物Ⅱ在NaOH溶液中完全水解的化学方程式为_________。
(2)化合物Ⅲ的结构简式为________,化合物Ⅳ通过消去反应生成化合物I的化学方程式为______(注明反应条件)。
(3)化合物Ⅴ是化合物Ⅱ的同分异构体,苯环上有两个取代基且能发生银镜反应,Ⅴ的核磁共振氢谱除苯环峰外还有两组峰,峰面积之比为1︰2,Ⅴ的结构简式为_________(写一种即可)。
(4)聚合物 单体的结构简式为_________。用类似反应①的方法,利用丙炔与合适的原料可以合成该单体,化学方程式为________。
单体的结构简式为_________。用类似反应①的方法,利用丙炔与合适的原料可以合成该单体,化学方程式为________。