下列有关元素的性质及其递变规律正确的是( )
| A.IA族与ⅦA族元素间形成的化合物都是离子化合物 |
| B.第三周期元素从左到右,最高正价从+1递增到+7 |
| C.同主族元素的简单阴离子还原性越强,其单质的氧化性越强 |
| D.同周期金属元素的化合价越高,其原子失电子能力越强 |
已知:HCN(aq)与NaOH(aq)反应的ΔH="-12.1kJ/" mol;HCl(aq)与NaOH(aq)反应的ΔH="-55.6" kJ/mol,则HCN在水溶液中电离的ΔH等于
| A.+43.5 kJ/mol | B.-43.5 kJ/mol | C.-67.7kJ/mol | D.+67.7 kJ/mol |
反应2X(g)+Y(g)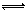 2Z(g)(正反应为放热),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量n(Z)与反应时间t的关系如图所示,下述判断正确的是
2Z(g)(正反应为放热),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量n(Z)与反应时间t的关系如图所示,下述判断正确的是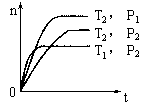

微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是
Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-=ZnO+H2O;
Ag2O+H2O+2e-=2Ag+2OH-。根据上述反应式,判断下列叙述中正确的是
| A.在使用过程中,电池负极区溶液的pH增大 |
| B.电子由Ag20极经外电路流向Zn极 |
| C.Zn是负极,Ag2O是正极 |
| D.Zn电极发生还原反应,Ag2O电极发生氧化反应 |
将pH=3的盐酸和pH=11的氨水等体积混合,完全反应后,溶液中离子浓度关系正确的是
| A.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B.c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C.c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
根据下列事实,判断离子的氧化性顺序为:①A + B2+ ="==" A2+ + B
②D + 2H2O ="==" D(OH)2 + H2↑③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2+ + 2e- = E,B - 2e- = B2+
A.D2+>A2+>B2+>E2+ B.D2+>E2+>A2+>B2+
C.E2+>B2+>A2+>D2+ D.A2+>B2+>D2+>E2+