原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等。甲的化学式为YX3,是一种刺激性气味的气体,乙是由X、Y、Z组成的盐。下列说法正确的是
| A.原子半径:W>Y>Z,简单离子半径: Y>Z>W |
| B.YX 3的空间构型是三角锥型,而Y2X4的空间构型类似于乙烯的空间构型 |
| C.测得乙的水溶液呈酸性,则溶液中乙盐阳离子浓度大于酸根离子浓度 |
| D.W的氯化物熔点低,易升华,但水溶液能导电,由此推断它属于弱电解质 |
用四种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是
| 选项 |
操作及现象 |
溶液 |
| A |
通入CO2,溶液变浑浊 |
饱和Na2CO3溶液 |
| B |
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 |
Na2SiO3溶液 |
| C |
通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 |
Ca(ClO)2溶液 |
| D |
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 |
澄清石灰水 |
如右图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是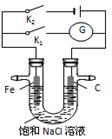
| A.K1闭合,铁棒上发生的反应为2H++2e-=H2↑ |
| B.K1闭合,石墨棒周围溶液pH逐渐升高 |
| C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D.K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体 |
下列说法正确的是
| A.含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子 |
B.500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中反应生成NH3(g),反应达到平衡时放出的热量为7.72kJ,其热化学方程式为: △H=-38.6kJ·mol-1 △H=-38.6kJ·mol-1 |
C.对于可逆反应 △H﹤0,升高温度,可使反应速率增大,反应逆向移动 △H﹤0,升高温度,可使反应速率增大,反应逆向移动 |
| D.元素原子的最外层电子数的多少与其非金属性的强弱无必然联系。 |
在100 mL含等物质的量的HBr和H2SO3的溶液中通入0.025 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。则原溶液中HBr和H2SO3的浓度都等于
| A.0.16 mol·L-1 | B.0.02 mol·L-1 | C.0.20 mol·L-1 | D.0.25 mol·L-1 |
下列说法正确的是
| A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同; |
| B.同温同压下,反应H2(g)+Cl2(g)==2HCl(g)在光照和点燃条件下的ΔH不同; |
| C.已知:①2H2(g)+O2(g) ="=" 2H2O(g) ΔH=-a kJ/mol, ②2H2(g)+O2(g) ="=" 2H2O(l) ΔH=-b kJ/mol,则a>b; |
| D.已知:①C(s,石墨)+O2(g) ="=" CO2(g) ΔH=-393.5 kJ/mol, |
②C(s,金刚石)+O2(g) ="=" CO2(g) ΔH=-395.0 kJ/mol,则
C(s,石墨) ="=" C(s,金刚石) ΔH=+1.5 kJ/mol;