下列关于物质的检验说法不正确的是( )
| A.加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定含有SO42- |
| B.观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后再用铂丝蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察 |
| C.待检液加入NaOH 溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+ |
| D.取少量久置的Na2SO3样品于试管中加水溶解,再加入足量盐酸有气体产生,然后加入BaCl2溶液有白色沉淀产生,说明Na2SO3样品已部分被氧化 |
磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性,制备时将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径在36~55 nm的磁流体。下列说法中正确的是
| A.所得的分散系属于悬浊液 |
| B.该分散系能产生丁达尔效应且其中胶粒带正电荷 |
| C.所得的分散系中分散质为Fe2O3 |
| D.所得分散系为胶体,且胶粒直径即为氢氧化铁分子直径 |
下列物质分类正确的是
①混合物:铝热剂、碱石灰、水玻璃、漂白粉 ; ②化合物:氯化钙、烧碱、冰水混合物、胆矾
③酸性氧化物:Mn2O7、N2O3、SiO2、NO2④碱性氧化物:Na2O2、CuO、Al2O3、MgO
⑤同素异形体:C60、C70、金刚石、石墨⑥强电解质:AlCl3、 BaSO4、MgO、 Ba(OH)2
| A.①②⑤⑥ | B.②③④⑥ | C.①②④⑤ | D.①②④⑥ |
把x mL CO2通过足量的Na2O2后再与y mL NO混合。x与y之和为30。设充分反应后气体的体积缩小为15 mL,(不考虑NO2转化为N2O4),则xy可能为( )
① 1 : 1 ② 2 : 1 ③ 5 : 4 ④ 7 : 5
| A.只有① | B.只有② | C.只有③④ | D.①②③④ |
一定量的铁与一定量的浓HNO3反应,得到硝酸铁溶液和NO2、N2O4、NO的混合气体,这些气体与3.36 L O2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸铁溶液中加入2 mol·L--1的NaOH溶液至Fe3+恰好沉淀,则消耗NaOH 溶液的体积是( )
| A.300 mL | B.150 mL | C.120 mL | D.90 mL |
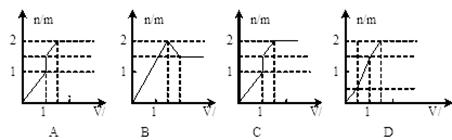
向含1mol HCl和1mol MgSO4的混合溶液中加入1mol/L的Ba(OH) 2溶液,产生沉淀的物质的量(n)与加入Ba(OH) 2溶液体积(V)间的关系图正确的是 ()