常温下,用 0.10 mol·L-1 NaOH溶液分别滴定20.00 mL 0.10 mol·L-1 HCl溶液和20.00 mL 0.10 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如下图所示,则下列说法正确的是( )

图1 图2
| A.图2是滴定盐酸的曲线 |
| B.a与b的关系是:a<b |
| C.E点对应离子浓度由大到小的顺序为: c(CH3COO-)> c(Na+)> c(H+)> c(OH-) |
| D.这两次滴定都可以用甲基橙作为指示剂 |
下列各项中,理由、结论及因果关系均正确的是
| 选项 |
理由 |
结论 |
| A |
相同物质的量浓度溶液的pH:BaCl2>MgCl2 |
碱性:Ba(OH)2>Mg(OH)2 |
| B |
相同物质的量的原子失去电子的数目:Al>Na |
还原性:Al>Na |
| C |
等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体,HX放出的氢气多 |
HX酸性比HY强 |
| D |
相同物质的量得到电子的数目:稀硝酸>浓硝酸 |
氧化性:稀硝酸>浓硝酸 |
下列离子方程式正确的是
| A.以石墨作电极电解CuCl2溶液:2Cl-+2H2O=2OH-+Cl2↑十H2↑ |
| B.双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O |
| C.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| D.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O |
设NA表示阿伏加德罗常数的数值,下列说法正确的是(H-1,C-12)
| A.1mol.L-1的Ca(ClO)2溶液中含ClO-数目为2NA |
| B.22.4LCl2分别与足量的Cu、Fe完全反应转移电子数分别为2NA、3NA |
| C.室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA(H-1,C-12) |
| D.1 mol -OH与1 molOH-所含电子数均为9 NA |
下列说法错误的是
| A.蔗糖、硫酸钡和水分别属于非电解质、强电解质、弱电解质 |
| B.甲醇、乙二醇(HOCH2CH2OH)互为同系物 |
| C.除去CO2中混有的SO2:用饱和NaHCO3溶液洗气,再干燥 |
| D.液溴易挥发,盛放在用水密封、玻璃塞塞紧的棕色试剂瓶中 |
以石墨电极电解200 mL CuSO4溶液,电解过程中转移电子的物质的量n(e—)与产生气体体积V(g)(标准状况)的关系如下图所示。下列说法中,正确的是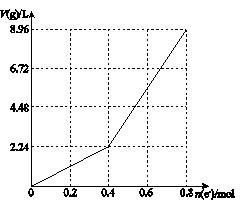
| A.电解前CuSO4溶液的物质的量浓度为2 mol/L |
| B.电解后所得溶液中c(H+)=2 mol/L |
| C.当n(e—)=0.6 mol时,V(H2)∶V(O2)=2∶3 |
| D.向电解后的溶液中加入16 g CuO,则溶液可恢复为电解前的浓度 |