如图,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则下列说法正确的是( )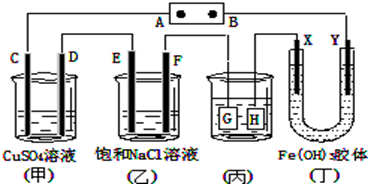
A.若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则A极的电极反应式为:C2H6 -14e-+ 18OH-= 2CO32- + 12H2O
B.欲用(丙)装置给铜镀银,H应该是Ag,电镀液选是AgNO3溶液
C.(丁)装置中Y极附近红褐色变深,说明氢氧化铁胶体带正电荷
D.C、D、E、F电极均有单质生成,且其物质的量比为1:2:2:2
在下列各组溶液中,离子一定能大量共存的是
| A.加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、I- |
| B.常温下,pH=1的溶液:Fe3+、Na+、NO3-、SO42- |
| C.滴入酚酞试液显红色的溶液:Mg2+、Al3+、Br-、SO42- |
| D.含0.1mol/LNH4Al(SO4)2·12H2O的溶液:K+、Ca2+、NO3-、OH- |
下列离子方程式的书写正确的是
A.弱酸尼泊金酸( )与碳酸氢钠溶液反应 )与碳酸氢钠溶液反应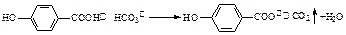 |
| B.将0.01mol氯气通入10 mL 1 mol / L的FeBr2溶液中 2Fe2++2Br-+3Cl2= 2Fe3++6Cl-+Br2 |
| C.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液 Ca2++ HCO3- +OH-= CaCO3↓+H2O |
| D.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至Ba2+刚好沉淀完全 |
Ba2++2OH-+H++ SO42- + NH4+ = BaSO4↓+ NH3·H2O +H2O
某药物分子结构简式如下图所示,下列关于该物质的说法不正确的是
| A.分子式为C21H20O3Cl2 |
| B.醚键上的氧原子至少与另外11个原子共面 |
| C.分子中不存在手性碳原子 |
| D.在一定条件下可发生加成、取代、氧化反应 |
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应:2Cu+H2O==Cu2O+H2 。下列说法正确的是
。下列说法正确的是

A.石墨电极上产生氢气 |
B.铜电极发生还原反应 |
C.铜电极接直流电源的负极 |
D.当有0.1mol电子转移时,有0.1molCu2O生成 |
有A、B、C三种短周期元素,最外层电子数之和为17,质子数之和为31。若C为Ar,则关于A、B两种元素的说法错误的是
 A.如果A是金属元素,则B可能是稀有元素
A.如果A是金属元素,则B可能是稀有元素
 B.如果A的单质通常情况下是气体,则B的单质通常情况下是固体
B.如果A的单质通常情况下是气体,则B的单质通常情况下是固体
 C.如果A的气态氢化物的水溶液显碱性,则B的气态氢化物的水溶液显酸性
C.如果A的气态氢化物的水溶液显碱性,则B的气态氢化物的水溶液显酸性
D.如果A的最高正价是+3,则B的单质有两种常见的同素异形体