甲、乙、丙三个密闭容器中分别充入一定量的A和B,发生反应: 。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如下图表所示:
。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如下图表所示:
下列说法正确的是
A. ,且该反应为吸热反应
,且该反应为吸热反应
B.x=2
C.若平衡后保持温度不变,改变容器体积平衡不移动
D. ℃下,若起始时向甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
℃下,若起始时向甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应: Sn(s)+Pb2+(aq)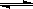 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是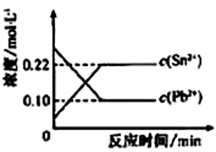
| A.往平衡体系中加入少量金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应的△H>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
常温下,浓度均为0.1mol/L CH3COOH溶液和HCN溶液的pH分别为m和n(1<m<n)。
下列叙述中不正确的是
| A.常温下,pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化小 |
| B.等温下,等浓度的CH3COONa和NaCN溶液pH,后者大 |
| C.HCN溶液和NaOH溶液不等体积混合后一定存在C(H+)―C(OH-)=C(CN-)―C(Na+) |
| D.溶液中由水电离出的C(H+),前者是后者的10m-n倍 |
常温下,将100 mL 的0.02 mol·L-1的Ba(OH)2溶液和100 mL 的0.02 mol·L-1的NaHSO4
溶液混合,若忽略溶液体积变化,则混合后的溶液
| A.pH=2 |
| B.pH=12 |
| C.由水电离产生的c(H+)=1.0×10-2 mol·L-1 |
| D.溶质的物质的量浓度为0.02 mol·L-1 |
25℃时,下列溶液中微粒存在情况合理的是
| A.Fe2+、Mg2+、ClO-、Cl-能大量共存 |
| B.含Br-、K+、Na+、HSO3-的溶液,通入SO2后这些离子仍能大量共存 |
C.含K+、Na+、NO3-、CH3COO-的溶液中c(H+) |
| D.硝酸钠和碘化钡混合溶液中,溶质离子浓度为c (Ba2+)=0.2mol/L,c(Na+)=0.2mol/L,c(NO3-)=0.3mol/L,c(I-)=0.1mol/L |
某恒温密闭容器中,可逆反应A(s)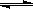 B + C(g) -Q,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B + C(g) -Q,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)生成=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q