某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的是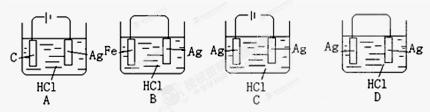
下列有关说法不正确的是( )
| A.C3H8中碳原子都采用的是sp3杂化 |
| B.O2、CO2、N2都是非极性分子 |
| C.酸性:H2CO3<H3PO4<H2SO4<HClO |
D.CO的一种等电子体为NO+,它的电子式为 |
下列说法正确的是( )
| A.离子晶体中可能含有共价键,一定含有金属元素 |
| B.分子晶体中可能不含共价键 |
| C.非极性分子中一定存在非极性键 |
| D.对于组成和结构相似的分子晶体,一定是相对分子质量越大,熔沸点越高 |
中心原子采取sp2杂化的是 ( )
| A.NH3 | B.BCl3 | C.PCl3 | D.H2O |
科学家最近又发现了一种新能源——“可燃冰”。它的主要成分是甲烷分子的结晶水合物(CH4·nH2O)。其形成过程是:埋于海底地层深处的大量有机质在缺氧环境中,厌氧型细菌把有机质分解,最后形成石油和天然气,其中许多天然气被包进水分子中,在海底的低温与高压下形成了类似冰的透明晶体,这就是“可燃冰”。这种“可燃冰”的晶体类型是( )
| A.离子晶体 | B.分子晶体 | C.原子晶体 | D.金属晶体 |
下列说法或有关化学用语的表达正确的是( )
| A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 |
B.基态Fe原子的外围电子排布图为: |
| C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 |
| D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素 |