NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2的反应方程式是(未
配平):MnO4-+NO2-+ → Mn2++NO3-+H2O。下列叙述中正确的是( )
→ Mn2++NO3-+H2O。下列叙述中正确的是( )
| A.该反应中NO2-是还原剂 |
| B.反应过程中溶液的pH 减小 |
| C.生成1 mol NaNO3时消耗2.5 mol KMnO4 |
D. 中的粒子是OH- 中的粒子是OH- |
关于下列四个图像的说法中正确的是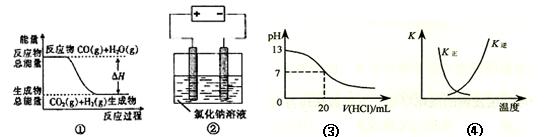
A.图①表示可逆反应“CO(g)+H2O(g) CO2(g)+H2(g)”中的△H大于0 CO2(g)+H2(g)”中的△H大于0 |
| B.图②是在以石墨为电极电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1:1 |
| C.图③表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
D.图④中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+ 28HNO3 ==9Fe(NO3)x + NO↑+ 14H2O
下列判断合理的是
| A.Fe(NO3)x中的x为2 |
| B.反应中每还原0.4 mol氧化剂,就有1.2 mol电子转移 |
| C.稀HNO3在反应中只表现氧化性 |
| D.磁性氧化铁中的所有铁元素全部被氧化 |
木糖醇是一种新型的甜味剂,近年来正悄悄的走进人们的生活。木糖醇是一种理想的蔗糖代替品,它具有甜味适中、溶解性好、防龋齿、适合糖尿病患者等优点。木糖醇是一种白色粉末状的固体,结构简式为:CH2OH(CHOH)3CH2OH,下列有关木糖醇的叙述正确的是
| A.木糖醇与核糖(C5H10O5)互为同分异构体 | B.木糖醇与葡萄糖一样是一种单糖 |
| C.木糖醇可以与乙酸发生酯化反应 | |
| D.木糖醇与甘油(CH2OHCHOHCH2OH)互为同系物 |
下列说法正确的是
A.液化石油气和天然气的主要成分都是甲烷
B.苯分子中的6个碳原子之间的键完全相同,是一种 介于单键和双键之间的独特的键
介于单键和双键之间的独特的键
D.3-甲基戊烷的一氯代产物有(不考虑立体异构)五种
D.1 葡萄糖可水解生成2
葡萄糖可水解生成2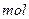 乳酸(
乳酸(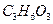 )
)
下列各项表述正确的是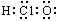
A.次氯酸的电子式: 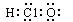 |
| B.表示中和热的热化学方程式:NaOH(aq)+HF(aq)=NaF(aq)+H2O(l)△H=-57.3kJ/mol |
C.H2S电离的方程式为:H2S 2H++S2- 2H++S2- |
D.标准状况下,1.12L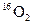 和1.12L 和1.12L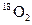 均含有0.1 均含有0.1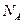 个氧原子 个氧原子 |