25℃时,弱酸的电离平衡常数如下表:
| 弱酸 |
CH3COOH |
HCN |
H2CO3 |
| Ka |
1.8×10-5 |
4.9×10-10 |
K1:4.3×10-7 K2:5.6×10-11 |
下列有关说法正确的是( )
A.等物质的量浓度的各溶液的pH关系为: pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol/L HCN与a mol/L NaOH溶液等体积混合后所得溶液呈中性
C.往冰醋酸中逐滴加水稀释,溶液导电能力始终保持减小
D.在Na2CO3溶液中:c(OH-)- c(H+)= c(HCO3-) + 2c(H2CO3)
下列过程中化学键被破坏的是
①碘升华②溴蒸气被木炭吸附③酒精溶于水④HCl气体溶于水⑤MgCl2溶解于水 ⑥NaCl熔化
| A.全部 | B.②③④⑤⑥ | C.④⑤⑥ | D.⑤⑥ |
关于化学式[TiCl(H2O)5]Cl2·H2O的配合物的下列说法中正确的是
| A.配位体是Cl-和H2O,配位数是9 |
| B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+ |
| C.内界和外界中的Cl-的数目比是1:2 |
| D.加入足量AgNO3溶液,所有Cl-均被完全沉淀 |
2008年秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺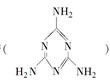 。下列关于三聚氰胺分子的说法正确的是
。下列关于三聚氰胺分子的说法正确的是
| A.所有碳原子采用sp3杂化,所有氮原子采用sp3杂化 |
| B.一个分子中共含有15个σ键 |
| C.属于极性分子,故极易溶于水 |
| D.分子内既有极性键又有非极性键 |
下列判断正确的是
| A.根据同周期元素的第一电离能变化趋势,推出P的第一电离能比S大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正化合价都是+7 |
| C.晶体中一定存在化学键 |
| D.正四面体分子中键角只能是109°28′ |
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示)。已知该分子中N—N—N键角都是108.1°,下列有关N(NO2)3的说法正确的是、
| A.分子中N、O间形成的共价键是非极性键 |
| B.分子中四个氮原子共平面 |
| C.该物质既有氧化性又有还原性 |
| D.15.2 g该物质含有6.02×1022个原子 |