(1)已知热化学方程式:
4Al(s) + 3O2(g) = 2Al2O3 (s) ΔH1=-3288.6 kJ·mol-1,
4Fe(s) + 3O2 (g) =2Fe2O3 (s) ΔH2=-1631.8 kJ·mol-1,
则铝粉与氧化铁发生铝热反应的热化学方程式为 。
(2)已知标准状况下44.8L氢气燃烧生成液态水时放出571.6KJ的热量,氢气的燃烧热为 ;又已知1mol液态水变成气态时需要吸收44KJ的热量,则标准状况下22.4L氢气燃烧生成气态水的热化学方程式为 。
运用化学反应原理分析解答以下问题。
(1)弱酸在水溶液中存在电离平衡,部分0.1 mol·L-1弱酸的电离平衡常数如下表:
| 弱酸 |
电离平衡常数(25℃) |
| HClO |
K=2.98×10-8 |
| H2CO3 |
K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 |
K1=1.54×10-2 K2=1.02×10-7 |
①当弱酸的浓度一定时,升高温度,K值______(填“变大”、“变小”或“不变”)。
②下列离子方程式和有关说法错误的是。
a.少量的CO2通入次氯酸钠溶液中:2ClO-+ H2O + CO2 =" 2HClO" + CO32-
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO32-= 2HCO3-+SO32-
c.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)< c(NaClO)< c(Na2SO3)
d.相同温度时,等物质的量浓度三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为:V(H2CO3) >V(H2SO3) >V(HClO)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性。往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式:,该反应的氧化产物是。
(2)工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统产生很大损害,必须进行处理后方可排放。
①在废水中存在平衡:2CrO42-(黄色)+2H+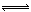 Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正反应方向移动,则下列说法正确的是。
Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正反应方向移动,则下列说法正确的是。
a.平衡常数K值可以不改变
b.达到新平衡CrO42-的消耗速率等于Cr2O72-的消耗速率
c.再达平衡前正反应速率一定大于逆反应速率
d.平衡移动后达到新平衡溶液pH一定增大
②Cr2O72-和CrO42-最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)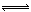 Cr3+(aq)+3OH‾(aq)
Cr3+(aq)+3OH‾(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,当c(Cr3+)降至10-3 mol·L-1,溶液的pH调至4时,________(填“有”或“没有”)沉淀产生。
(3)已知:①CO(g)+2H2(g)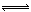 CH3OH(g)
CH3OH(g)
②2CH3OH(g)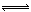 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
③CO(g)+H2O(g)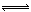 CO2(g)+H2(g)
CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为a1、a2、a3,则该温度下反应3CO(g)+3H2(g)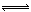 CH3OCH3(g)+CO2(g)的化学平衡常数K=L4·mol-4(用含a1、a2、a3的代数式表示)。向某固定体积的密闭容器中加入3molCO和3molH2,充分反应后恢复至原来温度,测定容器的压强为反应前的2/3,则CO的转化率_________。
CH3OCH3(g)+CO2(g)的化学平衡常数K=L4·mol-4(用含a1、a2、a3的代数式表示)。向某固定体积的密闭容器中加入3molCO和3molH2,充分反应后恢复至原来温度,测定容器的压强为反应前的2/3,则CO的转化率_________。
【化学—物质结构与性质】W、X、Y、Z(W、X、Y、Z分别代表元素符号)均为元素周期表中前四周期的元素,其原子序数依次增大,其中W、X、Y为短周期元素,它们的单质在通常状况下均为无色气体。X元素的基态原子在同周期元素基态原子中含有的未成对电子数最多,Y元素的基态原子中s能级上的电子数等于p能级上的电子数,Z为金属元素,其基态原子是具有4s1结构的基态原子中质子数最多的原子,试回答下列各题:
(1)写出X的基态原子的核外电子排布式_________________;
(2)比较X、Y两元素基态原子的第一电离能大小:X_____Y(填“>”、“<”或“=”),理由是___________________;
(3)W、X两元素能形成一种常见气体M,每个M分子中含有l0个电子,M分子中心原子的杂化方式为______;W、X两种元素还能形成一种常见阳离子N,每个N中也含有10个电子,但在N与M中所含化学键的键角大小不同,其原因是______________;
(4)Z2+可与M分子在水溶液中形成[Z(M)4]2+,其中M分子和Z2+通过____________结合;
(5)单质Z的晶胞结构如图所示,则每个晶胞中含有原子Z的个数为______________。
【化学——化学与技术】石膏(CaSO4·2H2O)是某些化工生产中的副产物,其可用作医学材料和建筑材料,也可将石膏转化为硫酸钾肥料和氯化钙水合物储热材料,以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。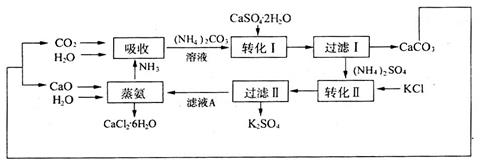
(1)本工艺中所用的原料除CaSO4·2H2O、KCl、H2O外,还需要________________;
(2)“吸收”工艺过程中,分别将CO2、NH3通入水中,反应生成(NH4)2CO3,实际操作中为生成较多的(NH4)2CO3,应先在水中通___________,理由是___________________;
(3)写出向石膏悬浊液中加入(NH4)2CO3溶液后发生反应的离子方程式:_____________;
(4)过滤I所得滤液中的溶质主要是(NH4)2SO4,也可能含有未完全反应的(NH4)2CO3,检验(NH4)2CO3是否存在的方法是____________________________________;
(5)滤液A中主要的溶质为__________________________________________________;
(6)上述工艺流程中是如何体现“绿色化学”思想的?____________________________。
在工农业生产和科学研究中,许多重要的化学反应需要在水溶液中进行,试分析并回答以下问题:
(1)向体积均为20.00 mL、浓度均为0.1 mol·L-1盐酸和醋酸溶液中分别滴加0.1 mol·L-1 NaOH溶液。随加入的NaOH溶液体积的增加,溶液pH的变化如下图所示:
①用NaOH溶液滴定醋酸溶液的曲线是__________________(填“I”或“Ⅱ”);
②实验前,上述三种溶液中由水电离出的c(H+)最大的是______________溶液(填化学式);
③图中V1和V2大小的比较:V1_____V2(填“>”、“<”或“=”);
④图I中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是:
______>______>______>________(用离子的物质的量浓度符号填空)。
(2)为了研究沉淀溶解平衡,某同学查阅资料并设计了如下实验(相关数据测定温度及实验环境均为25℃):
资料:AgSCN是白色沉淀;Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17
①步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是:_____________(用必要的文字和方程式说明);
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为________(至少答出两条明显现象);
③写出步骤4中沉淀转化反应平衡常数的表达式:K=______________。
甲醇是一种重要的化工原料,在生产中有着重要应用。工业上用甲烷氧化法合成甲醇,反应流程中涉及如下反应(下列焓变数据均在25℃测得):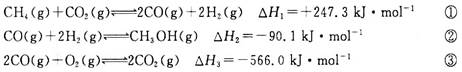
(1)25℃时,用CH4和O2直接制备甲醇蒸气的热化学方程式为________________;
(2)某温度下,向容积为4 L的恒容密闭容器中通入6 molCO2和6 mol CH4,发生反应①,5 min后反应在该温度下达到平衡,这时测得反应体系中各组分的体积分数相等,则该反应在0~5 min内的平均反应速率v(CO)=________mol·L-1·min-1;在相同温度下,将上述反应改在某恒压容器内进行,该反应的平衡常数________(填“增大”“不变”或“减小”);
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,25℃时,其反应的热化学方程式为:
科研人员对该反应进行了研究,部分研究结果如下图所示: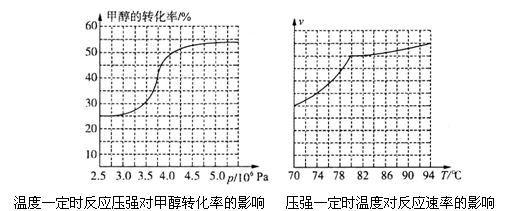
①根据反应体系的压强对甲醇转化率的影响并综合考虑生产成本因素,在下列各压强数据中,工业上制取甲酸甲酯应选择的是_______(填下列序号字母)
a.3.5×106Pab.4.0×l06Pac.5.0×106Pa
②用上述方法制取甲酸甲酯的实际工业生产中,采用的温度是80℃,其理由是______________
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示: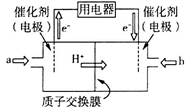
①通入气体a的电极是电池的_____(填“正”或“负”)极,其电极反应式为__________;
②25℃时,用此电池以石墨作电极电解0.5 L饱和食盐水(足量),若两极生成的气体共1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为_____(忽略溶液体积的变化)。