由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
(1)写出该反应的热化学方程式 。
(2)关于该反应的下列说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0
(3)该反应的平衡常数K的表达式为: 。
(4)温度降低,平衡常数K (填“增大”、 “不变”或“减小”)。
(5)为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)= 。
(6)下列措施中能使 增大的有 。
增大的有 。
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.体积不变,充入He(g)使体系总压强增大
氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:
SiO2+C+N2 Si3N4+CO
Si3N4+CO
根据题意完成下列各题:
(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了20mol氮气,反应生成了5mol一氧化碳,此时混合气体的平均相对分子质量是。
(3)分析反应可推测碳、氮气的氧化性:CN2(填“>”“<”“=”)。
(4)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是。
| A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备 |
| B.在电子工业上制成耐高温的电的良导体 |
| C.研发氮化硅的全陶发动机替代同类型金属发动机 |
| D.氮化硅陶瓷的开发受到资源的限制,没有发展前途 |
现有常见金属单质A、B、C和常见气体甲、乙、丙及物质D、E、F、G、H、I,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
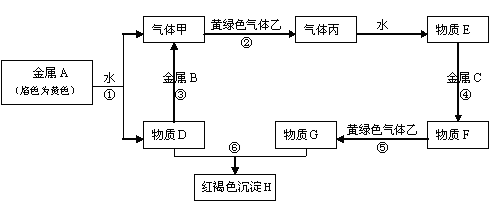
请根据以上信息回答下列问题:
⑴写出下列物质的化学式: A BF 丙
⑵写出下列反应离子方程式:
反应③
反应⑤
(3)写出反应⑧的化学方程式
(4)判断物质E是否是电解质(填“是”或“否”)
(12分)有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。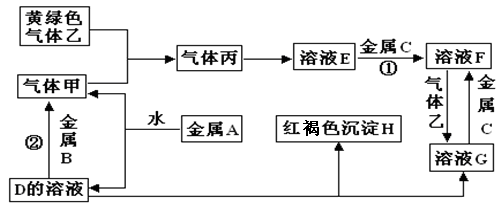
请根据以上信息回答下列问题:
Ⅰ.写出下列物质的化学式:
A__________________;H _______________; G_____________;乙______________;
Ⅱ.写出下列反应的化学方程式
反应①_________________________________________________________________
反应②_________________________________________________________________
有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42-、CO32-、Cl-和I-。你取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝;根据上述实验事实,你可知道该溶液中肯定含有的离子是①;肯定不存在的离子是② ;还不能确定是否存在的离子是③ 。
(12分)已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 平衡常数 |
Ka=1.8×10-5 |
Ka1=4.3×10-7 Ka2=5.6×10-11 |
Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:
A、CH3COOH B、Na2CO3 C、NaClO D、NaHCO3;
pH由小到大的排列顺序是;adcb(用字母表示)
(2)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是()
A、c(H+)B、c(H+)/c(CH3COOH)
C、c(H+)•c(OH-)D、c(OH-)/c(H+)
E、c(H+)•c( CH3COO-)/(CH3COOH)
(3)体积均为100mLpH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于CH3COOH的电离平衡常数(填大于、小于或等于),理由是. 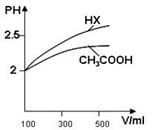
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)—c(Na+)= (填精确值),c(CH3COO-)/c(CH3COOH)=。