X、Y、Z、W是元素周期表中前30号元素,且原子序数依次增大。其相关信息如下表:
| 元素 |
相关信息 |
| X |
X原子基态时最外层电子数是其内层电子总数的2倍 |
| Y |
Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z |
Z元素的最高正价与负价代数和为6 |
| W |
W基态原子未成对电子数是前30号元素中最多的 |
(1)W位于元素周期表第 周期第 族,其基态原子最外层有 个电子。
(2)X的第一电离能比Y的 (填“大”或“小”),1mol X22-中含有的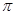 键数目为 。
键数目为 。
(3)X和Y的气态氢化物中,较稳定的是 (写化学式),Y的同族元素(包括Y)的最简单氢化物中沸点最低的是 。
(4)写出KZY3与HZ浓溶液反应制取Z2的化学方程式,并标出电子转移的方向和数目 。
(5)已知:X(s)+Y2(g)=XY2(g) ΔH 1= -393.5 kJ•mol-1
XY(g) +1/2Y2(g)=XY2(g) ΔH 2= -282.9 kJ•mol-1
则X(s)与Y2(g)反应生成XY(g)的热化学反应方程式为 。
5—氨基酮戊酸盐是一种抗肿瘤药,其合成路线如下:
(一)已知:
(1)5—氨基酮戊酸盐中有____种官能团。A分子结构中有一个环,不能使溴水褪色,且只有一种环境的氢原子,则A的结构简式为_____。
(2)G是B的一种同分异构体,能与NaHCO3溶液反应,能发生银镜反应,1molG与足量金属Na反应能生成1molH2,且G分子中不含甲基,符合上述条件的G可能的结构简式有 种。
(3)D→E的反应方程式___________;反应类型为__________________。
(二)已知:
(4)请结合题中所给信息,写出由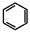 、CH3CH2COOH为原料合成
、CH3CH2COOH为原料合成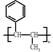 的合成路线流程图(无机试剂任选)。合成路线流程图示例:
的合成路线流程图(无机试剂任选)。合成路线流程图示例: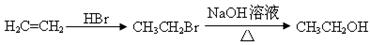
某有机物A只含C、H、O三种元素,可用作染料、医药的中间体,具有抗菌、祛痰、平喘作用。
(一)A的蒸气密度为相同状况下氢气密度的77倍,A中氧的质量分数约为41.6%,
(1)请结合下列信息回答:A的分子式是_____________ ;A中含氧官能团的名称是___________ 。
①A可与NaHCO3溶液作用,产生无色气体;
②1 mol A与足量金属钠反应生成H2 33.6L(标准状况);
③A可与FeCl3溶液发生显色反应;
④A分子苯环上有三个取代基,其中相同的取代基相邻,不同的取代基不相邻。
(二)已知:
有机物B的分子式为C7H8O2,一定条件下,存在如下转化,可最终生成A
(2)反应Ⅱ的化学方程式是________________ 。
(3)上述转化中,反应Ⅰ、Ⅱ两步的作用是____________ 。
(4)B可发生的反应有_____________ (填字母)。
A.取代反应 B.加成反应 C.消去反应 D.水解反应
(三)芳香族化合物F与A互为同分异构体,可发生银镜反应,1 mol F可与含3 mol溶质的NaOH溶液作用,其苯环上的一卤代物只有一种。
(5)写出符合要求的F的2种可能的结构简式_____________ 。
利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应。常用来生产液氨和氨水。
完成下列填空:
(1)如图表示合成氨时生成1mol生成物时的能量变化,E的单位为kJ。请写出合成氨的热化学方程式____________________。
(热量用E1、E2或E3表示)。该图中的实线与虚线部分是什么反应条件发生了变化?
(2)在一定温度下,若将4amolH2和2amolN2放入VL的密闭容器中,5分钟后测得N2的转化率为50%,则该段时间用H2表示的反应速率为__________摩尔/(升秒)。若此时再向该容器中投入amolH2、amolN2和2amolNH3,判断平衡移动的方向是_____(填“正向移动”“逆向移动”或“不移动”)
(3)液氨和水类似,也能电离:2NH3 NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____________2×10-30(填“<”、“>”或“=”);②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:_______
NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____________2×10-30(填“<”、“>”或“=”);②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:_______
(4)工厂生产的氨水作肥料时需要稀释。用水稀释0.1mol/L稀氨水时,溶液中随着水量的增加而减少的是
| A.c(NH4+)/c(NH3•H2O) | B.c(NH3•H2O)/c(OH-) |
| C.c(H+)/c(NH4+) | D.c(OH-)/c(H+) |
2013年底,上海青浦发生一家三口误食亚硝酸盐造成两男孩身亡的惨剧。常见的亚硝酸盐主要是亚硝酸钠(NaNO2),它是一种白色不透明晶体,虽然形状很像食盐,而且有咸味,但有毒。亚硝酸钠和氯化钠的部分资料如下表:
| 亚硝酸钠(NaNO2) |
氯化钠(NaCl) |
|
| 水溶性 |
易溶,溶液呈弱碱性 |
易溶,溶液呈中性 |
| 熔点 |
271℃ |
801℃ |
| 沸点 |
320℃会分解 |
1413℃ |
| 跟稀盐酸作用 |
有红棕色的NO2气体放出 |
无反应 |
完成下列填空:
(1)氮元素最外层电子排布式为________,氮原子核外电子共占据了___个轨道。亚硝酸钠中各元素原子半径由大到小依次为_________,亚硝酸的电离方程式为:_______________________。
(2)亚硝酸盐中毒是因为亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,即血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象.美蓝是亚硝酸盐中毒后的有效解毒剂.下列说法不正确的是( )
A.高铁血红蛋白的还原性比亚硝酸盐弱
B.药品美蓝应具有还原性
C.中毒时亚硝酸盐发生还原反应
D.解毒时高铁血红蛋白被还原
(3)NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须处理后才能排放。处理方法之一:在酸性条件下, NaNO2与KI的物质的量为1:1时恰好完全反应,且I-被氧化为I2,此时产物中含氮的物质(A)为________(填化学式)。若利用上述方法制A,现有两种操作步骤:①先将废水酸化后再加KI;②先将KI酸化后再加入废水。哪种方法较好?____(填序号。假设废水中其它物质不反应)
(4)如要鉴别亚硝酸钠和氯化钠固体,下列方法不可行的是
A.观察并比较它们在水中的溶解速度 B.测定它们各自的熔点
C.在它们的水溶液中滴加甲基橙D.在酸性条件下加入KI淀粉试液
已知:①RCH=CH2+CO+H2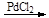 RCH2CH2CHO
RCH2CH2CHO
②

G(异戊酸薄荷醇酯)是一种治疗心脏病的药物,可由A(分子式为C7H8O,能与FeCl3溶液发生显色反应)和烯烃D(分子式C4H8)等为原料制取,合成路线如下: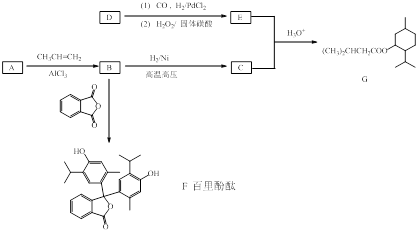
(1)A的名称为。
(2)F中含氧官能团名称和。
(3)D的结构简式为。
(4)某化合物是B的同分异构体,其分子中含有4种化学环境的氢原子,其对应的个数比为9∶2∶2∶1,写出该化合物的结构简式(任写一种)。
(5)正戊醛可用作香料、橡胶促进剂等,写出以乙醇为原料制备CH3(CH2)3CHO的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: