固体硝酸盐加热易分解且产物较复杂。已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下:
I.2KNO3 2KNO2+O2↑
2KNO2+O2↑
II.2Cu(NO3) 2 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
III.2AgNO3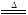 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
(1)某固体可能由KNO3、Cu(NO3)2、AgNO3三种硝酸盐中的一种或几种组成。取适量该固体充分加热,得到一定量气体。若该气体经水充分吸收后,剩余气体的体积在同温同压下为吸收前的1/6。 (忽略氧在水中的溶解)
①若该固体只是由一种盐组成,则该盐为 。
②若该固体是混合物,则该混合物的可能组成为 。
(2)某学习小组以Mg(NO3)2为研究对象,通过实验探究其热分解的产物,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):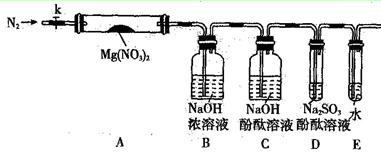
【实验步骤】
a.仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管A。
b.称取Mg(NO3)2固体3.7g置于A中,先通入一段时间N2,再关闭k,用酒精灯加热硬质玻璃管A。
c.待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g。
①步骤a的目的是 ;
②依据已知的三个方程式,再根据剩余固体的质量写出Mg(NO3)2热分解方程式为: 。
③若A中固体为AgNO3,用以上实验装置进行实验时,D 中的现象为 ,用离子方程式表示出现该现象的原因:_____________________ 。
④从实验安全的角度判断该实验装置有无缺陷?若有,应如何改进? 。
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH 、Cl-、Mg2+、Fe3+、CO
、Cl-、Mg2+、Fe3+、CO 、SO
、SO ,现每次取100.00 mL进行实验。
,现每次取100.00 mL进行实验。
①第一份加入AgNO3溶液有沉淀产生。
②第二份加足量NaOH后加热,收集到气体0.896 L(标准状态下)。
③第三份加足量BaCl2后,得干燥沉淀6.27 g,沉淀经足量盐酸洗涤干燥后,剩2.33 g。
试完成有关问题:
(1)判断K+、Cl-是否存在?K+_______,Cl-_______。(填下列序号)
A.一定存在
B.可能存在
C.一定不存在
(2)肯定存在的离子的原溶液中的物质的量浓度分别为________________。
汽车尾气中的NO,是造成大气污染的物质之一,但NO又是工业生产硝酸的中间产物,另外NO在人体的血管系统内又有传送信息的功能,有三位教授因此项研究成果而获得1998年诺贝尔奖。
(1)从上述事实说明我们应如何辩证地看待化学物质的作用________________________。
(2)写出NO造成酸雨的两个化学反应方式________________________,____________。
(3)在汽车尾气排放管中安装一个催化转化器,可将尾气中另一种有害气体CO跟NO反应转化为无毒气体,该反应的化学反应方程式为________________________________ 。
如图1所示:淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应。A、B、C都可以被强还原剂还原成为D(C6H14O6)。
图1
已知,相关物质被氧化的难易次序是:
RCHO最易,R—CH2OH次之, 最难。
最难。
请在下列空格中填写A、B、C、D的结构简式。
A:______________,B:________________,C:_________________,D:_______________。
人体缺少必要的微量元素会得病,因此有人认为应尽可能多吃含有这些元素的营养补剂,你认为这种观点对吗?
__________________________________________________,
理由是________________________________________________________________________。
水在自然界净化中要把有机污物自发地转变为简单的无机物质时,需要水中含有一定的氧气〔有机物(C、H、O)+O2→CO2+H2O〕,1 L水中含有的有机物转变为无机物所需要的氧的量称为生化需氧量(BOD),用g·L-1为单位表示,如果水的氧气量比BOD少,水就发臭,鱼和其他淡水生物就不会生存。某地区一条河水里有机物的质量分数为0.01%,此有机物的化学式可用C6H10O5表示,已知在正常大气压条件下,氧气在水中的溶解量是0.092 g·L-1。
(1)写出有机物在有氧气条件下转化为无机物的化学方程式_________________________。
(2)这条河水的生化需氧量为___________________________________________________。
(3)这条河中的鱼类____________(填“能”或“不能”)维持生命。