甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH1=-1451.6kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置: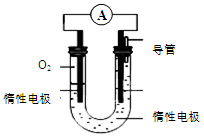
①该电池的能量转化形式为 。
②该电池正极的电极反应为 。
③工作一段时间后,测得溶液的pH减小,则该电池总反应的化学方程式为 。
现有浓度均为0.1 mol/L的下列溶液:①硫酸②醋酸③氢氧化钠④氯化铵⑤硫酸铝⑥碳酸氢钠。请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)。
(2)已知T℃,纯水中c(H+)=1×10-6.5 mol·L-1,则T℃(填“>”、“<”、“=”)25℃。在T℃时,将pH = 11的③溶液a L与pH = 1的①溶液b L混合(忽略混合后溶液体积的变化),若所得溶液的pH = 10,则a:b = 。
(3)将⑤溶液和⑥溶液混合时,可看到的实验现象是,产生该现象的原因是(用离子方程式解释原因)。
如图表示有关物质之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)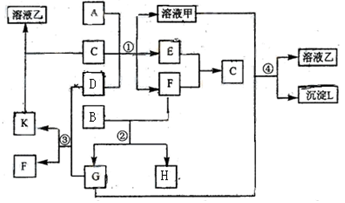



 (1)A、B、C、D代表的物质分别为、、、(填化学式);
(1)A、B、C、D代表的物质分别为、、、(填化学式); (2)反应①中的C、D均过量,该反应中所涉及的化学方程式分别是、
(2)反应①中的C、D均过量,该反应中所涉及的化学方程式分别是、 (3)反应②中,若B与F物质的量之比为4∶3,G、H分别是、(填化学式);
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是、(填化学式); (4)反应③产物中K的化学式为;
(4)反应③产物中K的化学式为; (5)反应④的离子方程式为。
(5)反应④的离子方程式为。
(共10分)已知有以下物质相互转化关系。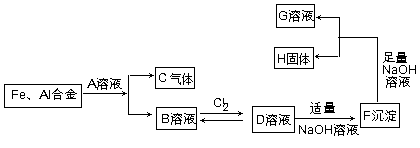
⑴写出化学式 G,H
⑵写出下列转化的离子方程式
B→D;
D→F、.
F→G
A、B、C、D四种化合物,其中A、C、D焰色反应均为黄色,而B的焰色反应为紫色,A、C和盐酸反应均得到D,将固体C加热可得到A,若在A的溶液中通入一种无色无味气体,又可制得C,若B的溶液滴加到硫酸亚铁溶液会先后出现白色沉淀E→灰绿色沉淀→红褐色沉淀F。试推断
(1)A:________、B:________、C、 D(填化学式)
(2) C+盐酸的离子方程式
(3)加热C得到A的化学方程式
除去下列物质中的少量杂质
(1)除去FeSO4溶液中的Fe2(SO4)3
选用试剂或方法: _______________________
离子方程式为 ________
(2)除去Fe(OH)3悬浊液中的Fe(OH)2
选用试剂或方法 __________化学方程式
(3)除去Fe2O3中的Al2O3
选用试剂或方法: 离子方程式为
(4)除去Al2O3中的Al(OH)3
选用试剂或方法: 化学方程式为