化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验,请你参与并完成对有关问题的解答。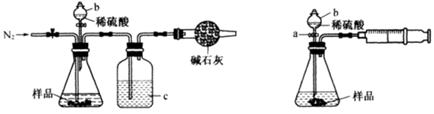
图1 图2
(1)甲同学用图1所示装置测定CO2的质量。实验时稀硫酸是与样品中的 (填“Na2CO3”或"NaCl”)发生反应。仪器b的名称是 。洗气瓶c中盛装的是浓硫酸,此浓硫酸的作用是 。
(2)乙同学用图2所示装置,取一定质量的样品(为m g;已测得)和足量稀硫酸反应进行实验,完成样品中Na2CO3”质量分数的测定。
①实验前,检查该装置气密性的方法是先打开活塞a,由b注入水至其下端玻璃管中形成一段水柱,再将针筒活塞向内推压,若b下端玻璃管中的 上升,则装置气密性良好。
②在实验完成时,能直接测得的数据是CO2的 (填“体积’’或“质量’’)。
(3)丙同学用下图所示方法和步骤实验: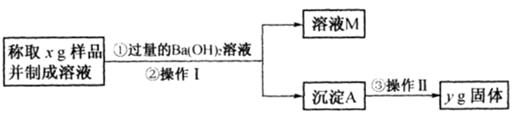
①操作I涉及的实验名称有 、洗涤;操作Ⅱ涉及的实验名称有干燥、 。
②丙测得的样品中Na2CO3质量分数的计算式为 。
(4)标准状况下,将672 mL CO2气通入50 mL1mol/LKOH溶液中,完全反应后,所得溶液中K2CO3和KHCO3的物质的量之比为(设反应前后溶液体积变化忽略不计) 。
1.中学化学中许多实验都要用到玻璃棒,但其作用可能不完全相同,玻璃棒通常有下列三种用途:①搅拌;②引流;③蘸取溶液。在“用NaOH溶液、Na2CO3溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO42-等杂质离子以获得较纯净的食盐”的实验中玻璃棒的作用可能有(填写编号)。
2.下图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是__________。
| A.①是量筒,读数为2.5mL |
| B.②是量筒,读数为2.5mL |
| C.③是滴定管,读数为2.5mL |
| D.②是温度计,读数是2.5℃ |
⑴在实验室进行的下列实验中,有关仪器的下端必须插入液面以下的是(填编号)。
①分馏石油时用的温度计②制备乙烯时用的温度计
③用水吸收溴化氢的导管口④用碱液吸收多余氯气的导管口
⑤制备H2的简易装置中加入稀硫酸用的长颈漏斗
⑥制备Fe(OH)2时,向FeSO4溶液中滴入NaOH溶液用的胶头滴管
已知有一白色粉末是由NaCl、Na2SO4、Na2CO3、CuSO4、MgCl2中的一种或几种组成。某同学欲探究这一粉末的组成,做了如下实验:
①取少量粉末,加水溶解,得无色透明溶液;
②取①中溶液少量,加入NaOH溶液,无明显现象发生;
③另取少量粉末,加入稀盐酸,无明显现象发生。
(1)请你根据该同学实验所得现象,推测这一粉末的可能组成是 __;
(2)若推测该粉末只由Na2SO4组成,请你在该同学实验基础上设计后续实验,以确定这包粉末的组成。[可供选择的试剂有:BaCl2溶液、AgNO3溶液、稀HNO3、NaOH溶液、Na2CO3溶液、Ba(NO3)2溶液、稀盐酸]
| 实验步骤 |
实验现象 |
反应离子方程式和结论 |
| ④ |
注:实验步骤的序号由你按顺序编号。实验现象、离子方程式和结论要与相应的实验步骤一一对应。
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl.3•6H2O晶体。(图中夹持及尾气处理装置均已略去)
(1)装置B中发生反应的化学方程式是_________________________ ______;
(2)反应前向A中放入碎瓷片的目的是_______________________________,装置A、B、E、三处均需要加热,A、B、E三处加热的先后顺序是(用A、B、E表示) ;
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。向滤液中加入KSCN溶液,溶液不显红色,说明滤液中不含有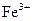 离子,你认为滤液中不含有
离子,你认为滤液中不含有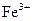 离子可能的原因是:__________________________________________。
离子可能的原因是:__________________________________________。
(4)该小组利用(3)中滤液制取FeCl3•6H2O晶体设计流程如下:
①步骤I若向100mL滤液中通入224mL Cl2(标准状况下)恰好完全反应,则原滤液中金属离子浓度约为__________mol/L。
②步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
_______________________________________________________________。
③该流程中需保持盐酸过量,主要原因是(结合必要的离子方程式简要说明)
__________________________________________________________________。
在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2ONH4Cl+NaHCO3(晶体)依据此原理,欲制得碳酸钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
(1)A装置中所发生反应的离子方程式为。
C装置中稀硫酸的作用为。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
参照表中数据,请分析B装置中使用冰水是因为。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在装置之间(填写字母)连接一个盛有的洗气装置,其作用是。
(4)利用改进后的装置进行实验,在B中的试管内析出了晶体,经必要的操作后得到了一种纯净的晶体。现有下列试剂:盐酸、浓氨水、生石灰、蒸馏水,利用本题所提供的试剂(只限一种)及试管、酒精灯等主要仪器,通过简单实验判断该晶体是碳酸氢钠晶体,而不是碳酸氢铵或食盐晶体,简述操作方法、实验现象及结论:
。
(5)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为。