1.中学化学中许多实验都要用到玻璃棒,但其作用可能不完全相同,玻璃棒通常有下列三种用途:①搅拌;②引流;③蘸取溶液。在“用NaOH溶液、Na2CO3溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO42-等杂质离子以获得较纯净的食盐”的实验中玻璃棒的作用可能有 (填写编号)。
2.下图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是__________。
| A.①是量筒,读数为2.5mL |
| B.②是量筒,读数为2.5mL |
| C.③是滴定管,读数为2.5mL |
| D.②是温度计,读数是2.5℃ |
用于分离提纯物质的方法有多种,请根据下列实验要求填空:
(1)分离饱和食盐水和泥沙的混合物,分离方法为,所用的玻璃仪器有。
(2)分离相溶的CCl4(沸点76.75℃)和甲苯(沸点110.6℃)的混合物,分离方法为 。
(3)从碘水里提取并得到固体碘,应先进行、操作,再进行操作。
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题:
⑴在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入__________,目的是__________。
⑵反应中加入过量乙醇,目的是__________________________。
⑶如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加乙酸,边加热蒸馏。这样操作可以提高酯的产率,其原因是________
______________________________________________。
⑷现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物,下列框图是分离操作步骤流程图: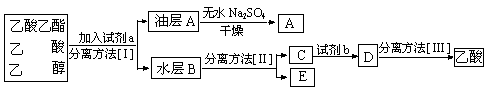
则试剂a是:____________,分离方法III是______________。
⑸甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都是先加NaOH溶液,中和酯中过量的酸,然后用蒸馏法将酯分离出来。甲、乙两人实验结果如下:
甲得到了显酸性的酯的混合物;
乙得到了大量水溶性的物质;
丙同学分析了上述实验目标产物后,认为上述实验都没有成功。
试解答下列问题:
①甲实验失败的原因是_______________________________________________。
②乙实验失败的原因是_______________________________________________。
用下列仪器的编号回答问题:①容量瓶②蒸馏烧瓶③分液漏斗④量筒⑤试管⑥烧杯⑦蒸发皿⑧坩埚
(1)可以直接用酒精灯加热的是;
(2)使用时必须检查是否漏水的是。
(每空2分,共14分)某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO3-六种离子。
甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是_____________。乙厂的废水中含有另外三种离子。对于该两厂的废水,可采取下列两种方法来处理。
(1)如果在废水中加一定量(选填:活性炭或铁粉),可以发生反应,离子方程式是,并且能够回收其中的金属(填写金属元素符号)。
(2)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出两个离子方程式:;。经过滤后的废水主要含,可用来浇灌农田。
(每空2分,共12分)用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸,步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸③稀释,转移④洗涤,再转移⑤定容、摇匀
(1)所需浓硫酸的体积是,量取浓硫酸所用的量筒的规格是(填序号)
(从下列规格中选用 A. 10ml B. 20ml C. 50ml D. 100ml)
(2)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大、偏小、无影响”填写)
A. 所用的浓硫酸长时间放置在密封不好的容器中
B. 容量瓶用蒸馏洗涤后残留有少量的水
C. 所用过的烧杯、玻璃棒未洗涤
D. 定容时俯视溶液的凹液面