工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g)  CH3OH(g)+Q
CH3OH(g)+Q
(1)能判断反应达到平衡状态的依据是(填字母序号,下同)________。
| A.生成CH3OH的速率与消耗CO的速率相等 | B.混合气体的密度不变 |
| C.混合气体的平均相对分子质量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①由表中数据判断该反应Q________(填“>”、“=”或“<”)0;
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2 mol/L,则CO的转化率为________,此时的温度为________。
(3)要提高CO的转化率,可以采取的措施是________。
a.升温;b.加入催化剂;c.增加CO的浓度;d.加入H2加压;e.加入惰性气体加压;f.分离出甲醇
(4)寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由:___________________________________________________。
-是一种新型硝化剂,其性质和制备受到人们的关注.
(1)
与苯发生硝化反应生成的硝基苯的结构简式是。
(2)
;
①反应达平衡后,若再通入一定量氮气,则
的转化率将 (填"增大"、"减小"、"不变")。
②下表为反应在T1温度下的部分实验数据:
|
|
0 |
500 |
1000 |
| e( )/ | 5.00 |
3.52 |
2.48 |
则500
内
的分解速率为。
③在
温度下,反应1 000
时测得
的浓度为4.98
,则
。
(3)如图所示装置可用于制备
,则
在电解池的区生成,其电极反应式为
。
 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:

(1)T的原子结构示意图为. (2)元素的非金属性为(原子的得电子能力):Q__W(填"强于"或"弱于")。
(2)元素的非金属性为(原子的得电子能力):Q__W(填"强于"或"弱于")。 (3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为.
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为. (4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是.
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是. (5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的
溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是.
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的
溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是. (6)在298K下,Q、T的单质各1
完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3
Q的单质,则该反应在298K下的
(6)在298K下,Q、T的单质各1
完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3
Q的单质,则该反应在298K下的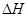 =(注:题中所设单质均为最稳定单质)
=(注:题中所设单质均为最稳定单质)
、
、
、
是周期表前36号元素中的四种常见元素,其原子序数一次增大。
、
的氧化物是导致酸雨的主要物质,
的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的
和黑色的ZO两种氧化物。 (1)
位于元素周期表第周期第_族。W的气态氢化物稳定性比
(1)
位于元素周期表第周期第_族。W的气态氢化物稳定性比 (填"强"或"弱")。
(填"强"或"弱")。 (2)
的基态原子核外电子排布式是,
的第一电离能比
的(填"大"或"小")。
(2)
的基态原子核外电子排布式是,
的第一电离能比
的(填"大"或"小")。 (3)
的最高价氧化物对应水化物的浓溶液与
的单质反应的化学方程式是
(3)
的最高价氧化物对应水化物的浓溶液与
的单质反应的化学方程式是

 (4)
的单质和
反应的热化学方程式是
(4)
的单质和
反应的热化学方程式是
A和B是具有相同碳原子数的一氯代物,A-I转换关系如图所示:
根据框图回答下列问题;
(1)B的结构简式是;
(2)反应③的化学方程式是;
(3)上述转换中属于取代反应的是;(填写反应序号)
(4)图中与E互为同分异构体的是;(填化合物代号)。图中化合物带有的含氧官能团有种。
(5)C在硫酸催化下与水反应的化学方程式是;
(6)I的结构简式是;名称是。
 以黄铁矿为原料生产硫酸的工艺流程图如下:
以黄铁矿为原料生产硫酸的工艺流程图如下:

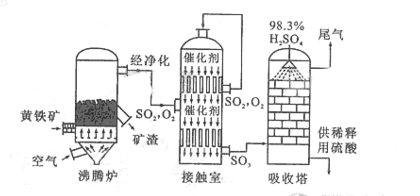

 (1)将燃烧黄铁矿的化学方程式补充完整
(1)将燃烧黄铁矿的化学方程式补充完整 4+11
4+11
 (2)接触室中发生反应的化学方程式是。
(2)接触室中发生反应的化学方程式是。 (3)依据工艺流程图判断下列说法正确的是(选填序号字母)。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)。 a. 为使黄铁矿充分燃烧,需将其粉碎
a. 为使黄铁矿充分燃烧,需将其粉碎 b. 过量空气能提高
的转化率
b. 过量空气能提高
的转化率 c. 使用催化剂能提高
的反应速率和转化率
c. 使用催化剂能提高
的反应速率和转化率 d. 沸腾炉排出的矿渣可供炼铁
d. 沸腾炉排出的矿渣可供炼铁 (4)每160g
气体与
(4)每160g
气体与 化合放出260.6
的热量,该反应的热化学方程是。
化合放出260.6
的热量,该反应的热化学方程是。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的
和铵盐。 ①
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的
。
吸收
的离子方程式是。
①
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的
。
吸收
的离子方程式是。 ② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00
相同浓度的
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00
相同浓度的
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。 部分测定结果;
部分测定结果; 铵盐质量为10.00
和20.00
时,浓硫酸增加的质量相同;铵盐质量为30.00
时,浓硫酸增加的质量为0.68
;铵盐质量为40.00
时,浓硫酸的质量不变。
铵盐质量为10.00
和20.00
时,浓硫酸增加的质量相同;铵盐质量为30.00
时,浓硫酸增加的质量为0.68
;铵盐质量为40.00
时,浓硫酸的质量不变。 计算:该铵盐中氮元素的质量分数是%; 若铵盐质量为15.00
。 浓硫酸增加的质量为。 (计算结果保留两位小数)
计算:该铵盐中氮元素的质量分数是%; 若铵盐质量为15.00
。 浓硫酸增加的质量为。 (计算结果保留两位小数)