下表是四种盐在不同温度下的溶解度(g/100g水):
| |
NaNO3 |
KNO3 |
NaCl |
KCl |
| 10℃ |
80.5 |
21.2 |
35.7 |
31.0 |
| 100℃ |
175 |
246 |
39.1 |
56.6 |
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
某同学设计用物质的量之比为1∶1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如下图所示:

(1)在①和②的实验过程中,需要控制的关键的实验条件是______________________,在上述晶体中,______(填“A”或“C”)应为硝酸钾晶体。
(2)在①的实验过程中,需要进行的操作依次是________________、________________、_____________。
(3)粗产品中可能含有杂质离子_______________________,检验其中一种离子的方法是________________________________________________________________________。
(4)为了洗涤所得的硝酸钾晶体,下列溶剂可用作洗涤剂的是___________(填编号)。
a.热水 b.冰水 c.95%的酒精 d.四氯化碳
(5)如取34.0g硝酸钠和29.8g氯化钾,加入70g水,在100℃蒸发掉50g水,维持该温度,过滤,析出晶体的质量为_______________。
(1)常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入 0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题: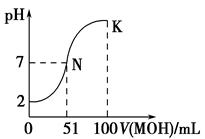
①由图中信息可知HA为________(填“强”或“弱”),理由是___________。
②常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”)。
③请写出K点所对应的溶液中离子浓度的大小关系: 。
(2)已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①为了验证上述哪种解释正确,做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。
| A.固体CH3COOK | B.固体CH3COONH4 |
| C.气体NH3 | D.固体NaHCO3 |
②若乙的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。
 已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
| A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B.c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
(1)若溶液中只溶解了一种溶质,该溶质是,上述离子浓度大小顺序关系中正确的是(选填序号)。
(2)若上述关系中D是正确的,混合后溶液中的溶质为 。
(3)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则混合前ab(填“>”、“<”、或“=”), 用a、b表示NH3·H2O的电离平衡常数为 。
今有①CH3COOH;②HCl;③H2SO4三种溶液,选择填空:
| A.①>②>③ | B.①<②<③ | C.①=②=③ | D.①=③>② |
E.①>②=③F.①<②=③ G.①=②<③ H.①=②>③
(1)当它们pH相同时,其物质的量浓度关系是。
(2)体积和物质的量浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为。
(3)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为。
(4)将pH相同的三种酸均稀释10倍后,pH关系为。
(1)FeCl3的水溶液呈 (“酸”、“中”、“碱”)性,常温时的pH7(填“>”、“=”、“<”),原因是(用离子方程式表示):。
(2)实验室在配制 FeCl3的溶液时,常将FeCl3固体先溶于中,然后再用蒸馏水稀释到所需的浓度。
(3)把FeCl3溶液蒸干,灼烧,最后得到的主要产物是。
(4)普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒中盛碳酸氢钠溶液,其化学反应的原理是(用离子方程式解释)。碳酸氢钠溶液中的电荷守恒式为 ,溶液中离子浓度由大到小的顺序为。
有A、B、C、D、E、F六种化合物,它们之间的反应关系如下所示:
①A+B→C+E②C+NaOH→蓝色沉淀 D+F③D A+E
A+E
④F+Ba(NO3)2→白色沉淀+NaNO3
回答下列问题(1)写出它们的化学式:
A _____ B____ C____ D ______ E _______ F_______。
(2)写出①④反应的离子方程式
①___________________________________
④___________________________________