某芳香族化合物H(C11H12O4)是有机合成工业的一种重要的中间产物,其合成路线如下。已知2molC分子可缩合生成1mol六元环化合物分子。F常温下是气体,水溶液具有很好的防腐杀菌效果,且能与新制氢氧化铜反应。请回答下列问题: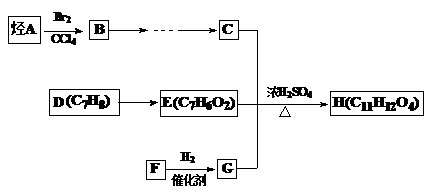
(1)F的电子式为 , A的结构简式
(2)B转化为C的条件是
| A.水解、酸化、氧化、还原 | B.氧化、水解、酸化、还原 |
| C.水解、酸化、还原、氧化 | D.氧化、酸化、水解、还原 |
(3)以C为原料可合成可降解塑料,试写出其化学方程式
(4)H与氢氧化钠溶液反应的化学方程式
(5)H的同分异构体有多种,请写出符合下列条件的同分异构体的结构简式 。(写一种即可)
①苯环上只有两个取代基,苯环上的一氯取代物只有两种
②1mol的H与足量的NaHCO3溶液反应,生成2molCO2
结合Na、Al、Fe的有关性质,回答下列问题。
(1)金属钠是具有银白色金属光泽的固体,常温下能与冷水剧烈反应,其反应的化学方程式为____________。
(2)铝既能与强酸反应,也能与强碱反应,且都放出H2,据此可区别铝和其他金属,请写出铝与氢氧化钠溶液反应的化学方程式_______________________。
(3)如下图所示,在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的气体。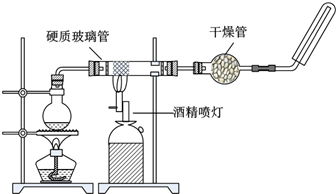
①有关反应的化学方程式是______________________。
②干燥管内可装入的试剂是_______________________。
阅读下列两条科普信息,回答问题。
①一个体重50Kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形式存在,而是以Fe2+和Fe3+的形式存在.亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
②在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛:CH2O表示,其中H为+1价,O为-2价)。
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是________(填字母)
A.Fe2+ B.Fe C.Fe3+
(2)在Fe +4HNO3=Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了______性和______性,则1molFe参加反应时,被还原的HNO3为______mol,转移电子的物质的量为______mol。
(3)第②信息中的CO2做氧化剂,写出②中的离子方程式:
CO2+____________+5H2O=CH2O+____________+8H+。
某银白色固体A在空气中点燃,火焰呈黄色,并生成淡黄色固体B;将A在空气中露置,最后变成白色固体C;将A投入水中生成D和气体;E是地壳中含量最多的金属元素的单质。回答下列问题:
(1)B的化学式是________;C的名称是_________。写出E与D溶液反应的化学方程式______。
(2)将1molA和1molE的混合物投入足量水中,产生气体在标准状况下的体积为_____________。
(3)把足量的铁粉投入到硫酸和硫酸铜的混合溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+和SO42-的物质的量浓度之比是______。
实验室用氯酸钾和二氧化锰制取氧气的反应方程式为:
2KClO3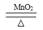 2KCl+3O2↑
2KCl+3O2↑
回答下列问题:
(1)该反应中被氧化的元素名称为_________,还原产物的化学式是________,生成1molO2时转移电子的数目是____________。
(2)从反应后的固体混合物中分离出难溶于水的MnO2具体操作步骤:____________。
(3)分离出的MnO2可用于实验室制取Cl2,化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,其离子方程式为____________。
MnCl2+Cl2↑+2H2O,其离子方程式为____________。
(4)若两个反应中转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为_______。
(5)以上两个反应都用到MnO2,其作用分别是________、________。
已知2A2(g)+B2(g) 2C3(g) △H="—akJ/mol" (a>0),在一个有催化剂的固定容积的容器中加入2 molA2和1 molB2,在500℃时充分反应达平衡后,C3的浓度为w mol/L,放出热量b kJ.
2C3(g) △H="—akJ/mol" (a>0),在一个有催化剂的固定容积的容器中加入2 molA2和1 molB2,在500℃时充分反应达平衡后,C3的浓度为w mol/L,放出热量b kJ.
(1)比较a________b( 填>、=、<);
(2)若将反应温度升高到700℃,反应的平衡常数将________(增大、减小或不变);
(3)能说明该反应已经达到平衡状态的是________
a、V(C3)=2V(B2);b、容器内压强保持不变
c、V逆(A2)=2V正(B2)d、容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________
a、及时分离出C3气体; b、适当升高温度;
c、增大B2的浓度; d、选择高效的催化剂