实验室用氯酸钾和二氧化锰制取氧气的反应方程式为:
2KClO3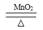 2KCl+3O2↑
2KCl+3O2↑
回答下列问题:
(1)该反应中被氧化的元素名称为_________,还原产物的化学式是________,生成1molO2时转移电子的数目是____________。
(2)从反应后的固体混合物中分离出难溶于水的MnO2具体操作步骤:____________。
(3)分离出的MnO2可用于实验室制取Cl2,化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,其离子方程式为____________。
MnCl2+Cl2↑+2H2O,其离子方程式为____________。
(4)若两个反应中转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为_______。
(5)以上两个反应都用到MnO2,其作用分别是________、________。
水杨酸是合成阿斯匹林的重要原料。水杨酸的学名邻羟基苯甲酸,结构简式为
请回答下列问题:
(1)请写出水杨酸中除苯环外具有的官能团;
(2)请写出与水杨酸互为同分异构体,既属于酚类又属于酯类化合物的结构简式:
。
(3)写出水杨酸与碳酸氢钠反应的化学方程式:
(4)在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林可表示为:
则阿斯匹林的分子式为;1摩尔阿司匹林完全水解需要氢氧化钠溶液____摩尔。
(5)阿斯匹林药片需要保存在干燥处,受潮的药片易变质不宜服用;检验受潮药片是否变质的试剂是(只选一种试剂即可)
1000℃时,在恒容密封容器中发生下列反应:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)该温度下,在2L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。
则5分钟内H2的平均反应速率为。
(2)能说明该反应已达到平衡状态的是____(填序号)。
a.容器内压强保持不变 b.容器内气体密度保持不变
c.c(H2)=c(H2O) d.v正(H2)=v逆(H2O)
(3)向该容器中分别加入以下物质,对平衡的影响如何?,(填“正向移动”,“逆向移动”或“不发生移动”)
①加入少量Na2SO4固体,则平衡:②加入少量灼热的碳粉,则平衡:__
(4)若将反应后的物质溶于水,用有关离子方程式说明上述反应产物水溶液的酸碱性____,欲使该溶液中S2-浓度增大,平衡逆向移动,可加入的物质是。
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理经处理后钢铁零件表面生成Fe3SO4的致密的保护层——“发蓝”。主要反应如①②③:
①3Fe+NaNO2+5NaOH→3NaFeO2+NH3+H2O
②___Na2FeO2+____NaNO2+____H2O→Na2Fe2O4+NH3+NaOH
③Na2FeO2+Na2Fe2O4+2H2O Fe3O4+4NaOH
Fe3O4+4NaOH
(1)配平化学方程式②,标出电子转移方向和数目。
(2)上述反应②中还原剂为,被还原物质是____。
若有1mol Na2Fe2O4生成,则反应中有____mol电子转移。
(3)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是:。
组成生命细胞的11种宏量元素(约占人体总质量的99.97%),全部位于周期表的前20号。其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素。
(1)这六种元素中除H、C、O、P、S外,应该还有____(写元素符号),它的原子最外层共有种不同运动状态的电子;与它同周期,且单质熔点最高的元素在周期表中的位置。
(2)糖类是人体获得能量的来源之一。已知1mol葡萄糖在人体内完全氧化为二氧化碳和水,放出2804 kJ的热量,该反应的热化学方程式____。
(3)CO2是一种温室气体,它的电子式为,将其转变其他化工原料,必须破坏的化学键属于____.(填“极性”或“非极性”)键。
(4)元素周期表中元素的性质存在递变规律,下列关系正确的是____(填序号)。
a.离子半径:S2-> Na+'>O2->H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原性:PH3>H2S>HCl>HF
(5)下表为部分非金属元素与氢形成共价键的键长与键能数据:
根据表中数据,归纳共价键键能与键长的关系。
(15分)某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色:J分子内有两个互为对位的取代基。在一定条件下有如下的转化关系:(无机物略去)
 (1)①A物质的名称为:______。(2分) ②X E+K的反应类型是______。(2分)
(1)①A物质的名称为:______。(2分) ②X E+K的反应类型是______。(2分)
(2)G、F中所含的含氧官能团的名称分别为___________、___________。(各1分)
(3)E与H反应的化学方程式是________________________________;(2分)
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,
B→I的化学方程式________________________________________;(2分)
(5)已知J有多种同分异构体,符合下列性质的J的同分异构体共有_____种。(3分)
①与FeCl3溶液作用显紫色; ②与新制Cu(OH)2悬浊液作用产生红色沉淀;
③苯环上的一卤代物有2种。写出其中一种一氯代物的结构简式____________(2分)