工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:

|
(1)金属M为 ,操作1为 。
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。| 温度/℃ |
10 |
30 |
60 |
90 |
| 浓度/mol・L-1 |
0.21 |
0.17 |
0.14 |
0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 。
研究有机物一般经过以下几个基本步骤:分离、提纯 → 确定实验式 → 确定分子式 → 确定结构式。有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
(2)A的分子式为。] |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团 。 |
(4)A的核磁共振氢谱如下图: |
(4)A中含有种氢原子。 综上所述, A的结构简式为。 |
煤的综合利用是当代化学工业的趋势,以煤为原料可合成重要化工中间体G。其中B与乙酸互为同分异 构体,能与Na反应放出氢气。
构体,能与Na反应放出氢气。
已知:① CH3CHO + CH3CHO
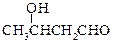
② (甘氨酸)
(甘氨酸)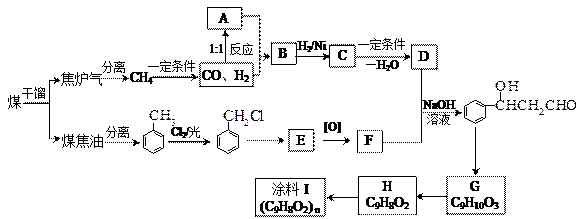
回答下列问题:
(1)煤的干馏属于____________变化,实验室检验D所用的试剂为________________________。
(2)A和F的结构简式分别为_____________________、______________________________。
(3)写出B→C的化学方程式___________________________________________________。
H→I的化学方程式___________________________________________________。
(4)能与Na2CO3溶液反应的E的芳香族化合物的同分异构体有________________种。
(5)根据已知信息,在一定条件下由G合成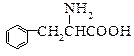 至少需要_______步化学反应。
至少需要_______步化学反应。
a.3 b.4 c.5 d.6
有机物A的结构简式是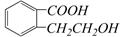 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
B. C.
C. D.
D. E.
E.
(1)A中含氧官能团的名称:;
(2)写出由A制取B的化学方程式:;
(3)写出A制取C、D、E三种物质的有机反应类型:CDE ;
(4)写出两种既可以看做酯类又可以看做酚类,且分子中苯环上连有三种取代基的A的同分异构体的结构简式(要求这两种同分异构体分子中苯环上的取代基至少有一种不同):
、。
在一定条件下,存在如下反应:2SO2(g)+ O2 (g)  2SO3(g);ΔH<0
2SO3(g);ΔH<0
(1)写出该反应的化学平衡常数表达式K=
(2)升高温度,该反应K值,SO2转化率,正反
应速率(填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是
(4)据图判断,反应进行至20min时,曲线发生变化的原因
是___________________(用文字表达),10min到15min的曲线变化的原因可能是(填编号)。
| A.加了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加SO3物质的量 |
(5)在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_______性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=______ 。
2SO2(g)+ O2(g) 2SO3(g);△H =" a" kJ/mol,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答:
2SO3(g);△H =" a" kJ/mol,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答: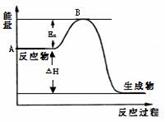
(1)图中A点表示_______________________,a=__________。
(2)Ea的大小对该反应的△H _______(填“有”或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点_________(填“升高”、“降低”或“不变”)。
(3)已知单质硫的燃烧热为296kJ·mol-1,写出反应的热化学方程式:_________________,常温常压下,由单质硫和氧气经两步反应,生成3mol SO3(g),放出的总热量为 。