针对下面10种元素,完成以下各小题。
| 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
C |
N |
O |
|
Ne |
| 3 |
Na |
Mg |
Al |
Si |
|
S |
Cl |
m] |
(1)地壳中含量最多的元素是 (填名称)。
(2)化学性质最不活泼的元素是 (填元素符号)。
(3)Al的原子结构示意图为 。
(4)C与N相比,原子半径较小的是 。
(5)最高价氧化物对应的水化物碱性最强的是 (填化学式)。
(6)MgO和Al2O3中,属于两性氧化物的是 。
(7)S和Cl相比,元素非金属性较强的是 。
(8)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出反应的化学方程式 。
(8分)由于反应的情况不同,反应热可以分为多种,如燃烧热和中和热等。
(1)下列各项中的△H表示物质的燃烧热的是(填字母,下同),表示物质的中和热的是。
| A.2H2(g)+O2(g)=2H2O(g)△H1 |
| B.C(s)+1/2O2(g)="CO" (g)△H2 |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3 |
| D.C(s)+O2(g)=CO2 (g)△H4 |
E.C6H12O6(s) + 6 O2(g) ="6" CO2(g)+6 H2O(l)△H5
F.NaOH(aq)+HCl(aq)="NaCl(aq)+" H2O(l)△H6
G.2NaOH(aq)+H2SO4 (aq)=Na2SO4 (aq)+ 2H2O(l)△H7
(2)25℃、101kPa时,1gC6H6(l)完全燃烧生成CO2(g)和H2O(l),放出41.8kJ的热量,则C6H6的燃烧热为,该反应的热化学方程式为。
某化学兴趣小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜(含有少量的锌、铁、银、金等金属和少量矿物杂质)的提纯,并对阳极泥和电解液中金属进行回收和含量测定。请回答以下问题。
(1)电解时,粗铜应与电源的极相连,阴极上的电极反应式为;电解过程中,硫酸铜的浓度会(选填“变大”“不变”或“变小”)。
(2)电解完成后,该小组同学将电解液过滤后对滤液和阳极泥分别进行处理:
①阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:。
②Cu的回收、滤液成分及含量的测定:以下是该小组设计的一个实验流程。
在上述流程中空格内填上相应的操作:、;100 mL滤液中Cu2+的浓度为 mol/l,Fe2+的浓度为mol/l。
I.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3A1F6)在熔融状态下进行电解,其阴极电极反应式为,其电极均由石墨材料做成,则电解时不断消耗的电极是(填“阴极”或“阳极”),冰晶石的作用为。
(2)铝电池性能优越,A1-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则负极的电极反应式为,正极附近溶液的pH(填“变大”“不变”或“变小”)。
已知:①2Al(s)+3Cl2(g)=2AlCl3(s)△H1=-1390 .8kJ/mol
②4Al(s)+3O2(g)=2Al2O3(s)△H2=-3339.6kJ/mol
③2C(s)+O2(g)=2CO(g)△H3=-221.0kJ/mol
Al2O3(s)+ 3C(s)+3Cl2(g)=2AlCl3(s)+3CO(g)的△H=。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中的能量变化示意图,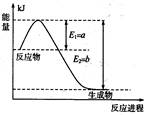
请写出合成氨的热化学反应方程式:(ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为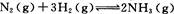 在一定温度下,
在一定温度下,
将一定量的N2和H2通入到体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是。
| A.增大压强 | B.增大反应物的浓度 | C.使用催化剂 | D.降低温度 |
Ⅲ.铁及其化合物在生活、生产中有广泛应用。请回答下列问题。
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,有3 m01FeS2参加反应,转移mol电子。
6SO2+Fe3O4,有3 m01FeS2参加反应,转移mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式:。
Ⅳ.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为。现以铅蓄电池为电源电解酸化的MnS04溶液,如图所示
铅蓄电池的总反应方程式为,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为,MnO2的理论产量为g。
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
| 编号 |
H2C2O4溶液 |
酸性KMnO4溶液 |
温度/℃ |
||
| 浓度/mol•L-1 |
体积/mL |
浓度/mol•L-1 |
体积/mL |
||
| ① |
0.10 |
2.0 |
0.010 |
4.0 |
25 |
| ② |
0.20 |
2.0 |
0.010 |
4.0 |
25 |
| ③ |
0.20 |
2.0 |
0.010 |
4.0 |
50 |
(1)该反应的离子方程式为;
(2)探究温度对化学反应速率影响的实验编号是(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是;
(3)实验①测得KMn04溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMn04)=mol·L-1·min-1;
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时c(Mn04-)~t的变化曲线示意图。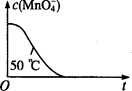
[化学—选修:化学与技术]三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:
(1)氯化水解法生产三氯氧磷的化学方程式为。
(2)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是(选填字母),滴定终点的现象为。
a.NH4Fe(SO4)2 b.FeCl2 c.甲基橙 d.淀粉②实验过程中加入硝基苯的目的是,如无此操作所测Cl元素含量将会(填“偏大”、“偏小”或“不变”)
(3)氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水。在废水中先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是。
②下图是不同条件对磷的沉淀回收率的影响图像。
处理该厂废水最合适的工艺条件为(选填字母)。
a.调节pH=9 b.调节pH=10 c.反应时间30 min d.反应时间120 min
③若处理后的废水中c(PO43-)=4×10-7 mol·L-1,溶液中c(Ca2+)=mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)