【化学选修3-物质结构与性质】(15分)a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
| a |
原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| b |
基基态原子的P轨道电子数比s轨道电子数少1 |
| c |
在周期表所列元素中电负性最大 |
| d |
位于周期表中第4纵行 |
| e |
基态原子M层全充满,N层只有一个电子 |
请回答:
(1)d属于________区的元素,其基态原子的价电子排布图为_________。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为________(用元素符号表示)。
(3)c的氢化物水溶液中存在的氢键有________种,任意画出一种_________。
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为________(用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为________;A的中心原子的轨道杂化类型为________;与A互为等电子体的一种分子为________(填化学式)。
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为________,若该晶体的相对分子质量为M,密度为ag/cm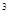 ,则晶胞的体积为________(
,则晶胞的体积为________(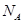 用表示阿伏加德罗常数的值)。
用表示阿伏加德罗常数的值)。
已知:6.4克铜与适量的浓硝酸反应,当铜完全溶解后,共收集到NO和NO2混合气体共2.24升(已折算为标准状况)。
(1)写出有关反应的离子方程式;
。
(2)被还原的HNO3的物质的量为;
(3)参加反应的HNO3的物质的量为。
(12分)如图所示:下图为A → E五种含同种元素的物质相互转化的关系图,其中A、B、C、D常温下都是气体,D呈红棕色。按要求回答下列问题:
(1) A物质的电子式;B物质是含键
的分子(填“极性”或者“非极性”)
(2)下列反应的化学方程式为:
①B→C:
②D→E:
(3)实验室制取B的化学方程式为:,通常用来干燥B气体;
已知B可以与灼热的氧化铜反应得到A气体和金属铜,则该反应的化学方程式为:。
下表是元素周期表的一部分, 针对表中的①~⑩种元素,
按要求填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
||
| 4 |
⑩ |
(1) 在这些元素中,化学性质最不活泼的元素是:(填元素符号),其原子结构示意图为。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是,碱性最强的化合物的电子式是。
(3) 最高价氧化物属两性氧化物的元素是(填元素符号);写出它的最高价氧化物与氢氧化钠溶液反应的化学方程式:。
(4) 用电子式表示元素④与⑦形成的化合物的形成过程:,
该化合物属于(填 “共价”或“离子”)化合物。
(5) 比较:氢化物稳定性②③,最高价氧化物对应水化物的酸性②⑥
(填“>”、“<”或“=”)。
(6) ⑥的最高价氧化物与烧碱溶液反应的离子方程式为;
(7) 工业上制取元素⑥的单质的化学方程式为
在配合物Ni(CO)4和 [Cu(NH3)4]2+,[Fe(SCN)]2+配合物离子中,提供空轨道接受孤对电子的原子或离子分别是:_______、_______、_______。
砷原子的最外层电子排布式是4s24p3,在元素周期表中,砷元素位于周期族;最高价氧化物的化学式为,砷酸钠的化学式是。