“海底黑烟囱”是海底热泉将地壳深处金属、非金属化合物带出时逐渐沉积形成的烟囱状通道,含有铜、锌、锰、钻、镍等金属的硫化物及金、银、铂等贵金属。“海底黑烟囱”的研究对海底矿产资源的勘探及金属硫化物成矿过程的认识均有极大的推动作用。
(1)“烟囱”周围的水样中发现了中子数是1,质子数是2的核素,该核素符号是 。
(2)“烟囱”内壁含有的结晶黄铁矿(主要成分是FeS2)在一定条件下发生如下反应: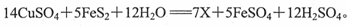 X的化学式是 ,氧化剂是 。
X的化学式是 ,氧化剂是 。
(3)“烟囱”外壁含有石膏(CaS04-2H20),在1400 0C时能分解生成CaO,水蒸气和另外两种气体,其中一种气体可使品红溶液褪色。写出1400℃时石膏分解的化学方程式 。
(4)“烟囱”底部存在的难溶物ZnS遇CuSO4认溶液会慢慢转化为铜蓝(CuS)。根据沉淀溶解平衡理论写出由ZnS转化为CuS的离子方程式 ;
若转化后溶液中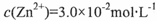 ,则c(Cu2+)= mol·L-1〔已知
,则c(Cu2+)= mol·L-1〔已知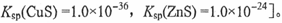
(5)“烟囱”中含有钻元素,LiCoO2可用作一种铿离子电池的正极材料。该锉离子电池充电过程中,负极发生的反应为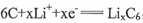 ,正极发生
,正极发生 之间的转化,写出放电时电池总反应方程式 。
之间的转化,写出放电时电池总反应方程式 。
氯酸钾与浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,反应的化学方程式为:2KClO3 + 4HCl(浓)=== 2KCl+2ClO2↑+Cl2↑+ 2H2O
(1)用双线桥表示上述反应中电子转移的方向和数目。
(2)浓盐酸在该反应中表现的性质是________(填序号)。
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
(3)上述反应产生0.2mol Cl2时,转移的电子数约为______________。
现有下列物质:①盐酸②纯碱③豆浆④烧碱⑤干冰⑥食盐水⑦氢气
⑧泥水。请根据它们的所属类别选择填入下表中(填序号)。
| 类别 |
单质 |
酸 |
碱 |
盐 |
氧化物 |
胶体 |
| 物质 |
近年来,我国部分地区相继发现一些以发热伴血小板减少为主要表现的感染性疾病病例。氯吡格雷是一种用于抑制血小板聚集的药物,根据原料的不同,该药物的合成路线通常有两条,其中一种合成路线如下: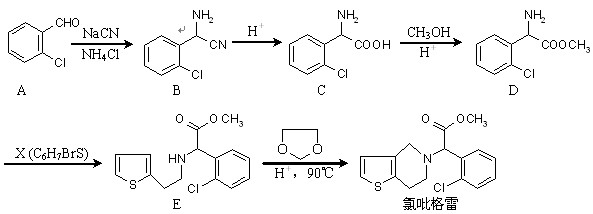
|
请回答下列问题:
(1)D的官能团除了氯原子外还有(填名称) 。 在酸性条件下生成氯吡格雷和另一种常见有机物,试写出该反应的化学方程式。
在酸性条件下生成氯吡格雷和另一种常见有机物,试写出该反应的化学方程式。
 的合成路线流程图(无机试剂任选)。合成路线流程示意图为:
的合成路线流程图(无机试剂任选)。合成路线流程示意图为: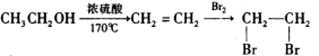
纳米级Cu2 O 粉末,由于量子尺寸效应,其具有特殊的光学、电学及光电化学性质,在太阳电池、传感器、超导体、制氢和电致变色、环境中处理有机污染物等方面有着潜在的应用。
Ⅰ.纳米氧化亚铜的制备
(1)四种制取Cu2O的方法如下:
①火法还原。用炭粉在高温条件下还原CuO;
②最新实验研究用肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。
已知:N2H4(l)+O2(g)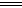 N2(g)+2H2O(l)△H="-a" kJ/mol
N2(g)+2H2O(l)△H="-a" kJ/mol
Cu(OH)2(s)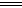 CuO(s)+H2O(l)△H="b" kJ/mol
CuO(s)+H2O(l)△H="b" kJ/mol
4CuO(s)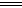 2Cu2O(s)+O2(g)△H="c" kJ/mol
2Cu2O(s)+O2(g)△H="c" kJ/mol
则该方法制备Cu2O的热化学方程式为。
③工业中主要采用电解法:用铜和钛作电极,电解氯化钠和氢氧化钠的混合溶液,电解总方程式为:2Cu+H2O Cu2O+H2↑,则阳极反应式为:。
Cu2O+H2↑,则阳极反应式为:。
④还可采用Na2SO3还原CuSO4法:将Na2SO3 和CuSO4加入溶解槽中,制成一定浓度的溶液,通入蒸气加热,于100℃~104℃间反应即可制得。写出该反应的化学方程式:。
Ⅱ.纳米氧化亚铜的应用
(2)用制得的Cu2O进行催化分解水的实验
①一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入10. 0 mol水蒸气,发生反应:
2H2O(g)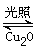 2H2(g)+O2(g)△H=+484 kJ·mol-1
2H2(g)+O2(g)△H=+484 kJ·mol-1
T1温度下不同时段产生O2的量见下表:
| 时间/min |
20 |
40 |
60 |
80 |
| n(O2)/mol |
1.0 |
1.6 |
2.0 |
2.0 |
前20 min的反应速率v(H2O)=;该该温度下,反应的平衡常数的表达式K=;若T2温度下K=0.4,T1T2(填>、<、=)
②右图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为,t2时改变的条件可能为;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为;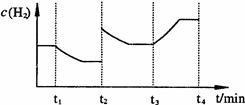
③用以上四种方法制得的Cu2O在其它条件相同下分别对水催化分解,产生氢气的速率v随时间t变化如图所示。下列叙述正确的是。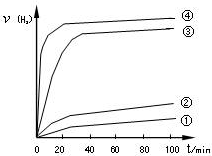
A.方法③、④制得的Cu2O催化效率相对较高
B.方法④制得的Cu2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有
D.Cu2O催化水分解时,需要适宜的温度
26.2011年9月29日21时天宫一号在酒泉卫星发射中心发射成功,标志着中国航天迈入了新的台阶,火箭推进剂是成功发射火箭的重要因素。推进剂主要由可燃剂和氧化剂组成,根据化学物质的形态不同推进剂可分为固体推进剂和液体推进剂,它们一般由C、H、O、N中的一种或几种元素组成。请回答下列问题:
(1)已知某固体推进剂主要由可燃剂(聚丁二烯等)和氧化剂甲(一种由三种元素组成的盐)组成,该盐溶液中加入硝酸银溶液,无明显现象,则甲物质所含的化学键类型,并用离子方程式表示甲的水溶液呈酸性的原因。
(2)已知某液体推进剂主要由可燃剂肼(N2H4)和氧化剂乙组成,乙所含有的电子数和肼分子相同,常温下,乙和肼反应生成一种常见的液态化合物和一种常见的稳定单质,试写出该反应的化学方程式。列举乙的另一种主要用途。
A.石油产品 B.四氯化碳 C.液氟D.纯碱
(4)戊也可作液体推进剂的氧化剂,取19.6g化合物戊,隔绝空气加热使其完全分解,生成氮气、氧气和二氧化碳,生成的氮气折合成标准状况下的体积为4.48L,生成的二氧化碳气体被足量的澄清石灰水吸收,得到10.0 g沉淀,生成的氧气折合成标准状况下的体积为L;戊的化学式为 。
(5)请设计一个实验方案,探究由上述四种元素组成的常见无机盐可能的成份。
__________________________________________