近年来,我国部分地区相继发现一些以发热伴血小板减少为主要表现的感染性疾病病例。氯吡格雷是一种用于抑制血小板聚集的药物,根据原料的不同,该药物的合成路线通常有两条,其中一种合成路线如下:
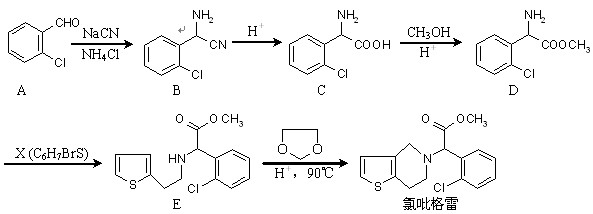
|
请回答下列问题:
(1)D的官能团除了氯原子外还有(填名称) 。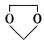 在酸性条件下生成氯吡格雷和另一种常见有机物,试写出该反应的化学方程式。
在酸性条件下生成氯吡格雷和另一种常见有机物,试写出该反应的化学方程式。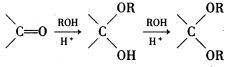
 的合成路线流程图(无机试剂任选)。合成路线流程示意图为:
的合成路线流程图(无机试剂任选)。合成路线流程示意图为: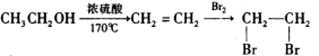
下列共有四组物质,请按要求回答下列问题
| X |
Y |
Z |
|
| ① |
NaOH溶液 |
Al(OH)3 |
稀硫酸 |
| ② |
MgCl2溶液 |
酚酞溶液 |
NaCl溶液 |
| ③ |
Na2O |
Na2CO3 |
NaHCO3 |
| ④ |
KOH溶液 |
Al |
稀盐酸 |
(1)同组物质中,X、Y、Z均是属于电解质的是 (填数字符号)。
(2)同组物质中,Y既能与X发生氧化还原反应,又能与Z发生氧化反应反应的是 (填数字符号)。
(3)写出第①组X与Y反应的离子方程式 。
(4)若只用一种试剂即可将第②组物质区分开来,该试剂是 。
(5)第③组固体Y中混入了少量的Z,除去少量的Z的最好方法是 。
NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是____________。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有____________(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是____________。
| A.NaCl | B.NH4Cl | C.HNO3 | D.浓H2SO4 |
(1)0.5 mol CO2的质量为___________,其中含有__________个CO2分子,在标准状况下的体积是 。
(2)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为____________。
(3)想一想:Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液体)这三种物质为什么可以归为一类,下列哪些物质可以和它们归为一类 (填序号)。
A 75%的酒精溶液 B硝酸钠 C碱石灰 D豆浆 E过氧化钠
(4)洁厕灵(强酸性,含盐酸)与84消毒液(碱性,含NaClO)混用可能使人中毒。请写出中毒涉及反应的离子方程式 。
某工业废水中含有大量的FeSO4、较多的Cu2+和少量的Fe3+。为了较少污染并变废为宝,拟从该废水中回收硫酸亚铁和金属铜,其流程如下图。请完成下列问题。
(1)检验工业废水中含有Fe3+的方法是 。
(2)工业废水中加入过量铁粉时,有Fe3+参加的离子反应方程式为 。
(3)操作Ⅰ为 。
(1)将117 g NaCl溶于水配制成1 L溶液,该溶液中NaCl的物质的量浓度为 。
(2)在标准状况下,将V L A气体(摩尔质量为M)溶于0.1 L水中,所得溶液的密度为,则此溶液的物质的量浓度为 。
(3)某硫酸溶液的物质的量浓度为c1,密度为ρ1;另一种硫酸溶液的物质的量浓度为c2,密度为ρ2,将它们等体积混合后,所得溶液的密度为ρ3,则混合后硫酸的物质的量浓度为 。
A. |
B. |
C. |
D. |