 请回答氯碱的如下问题:
请回答氯碱的如下问题:
 (1)氯气、烧碱是电解食盐水时按照固定的比率(质量比)生成的产品。理论上=要求计算表达式和结果);
(1)氯气、烧碱是电解食盐水时按照固定的比率(质量比)生成的产品。理论上=要求计算表达式和结果);
 (2)原料粗盐中常含有泥沙和等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①、②(盐酸)③,这3种试剂添加的合理顺序是(填序号)
(2)原料粗盐中常含有泥沙和等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①、②(盐酸)③,这3种试剂添加的合理顺序是(填序号)
 (3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
 ①
①
图中分别是、(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小;
 ②分别写出燃料电池中正极、负极上发生的电极反应正极:; 负极:;
②分别写出燃料电池中正极、负极上发生的电极反应正极:; 负极:;
 ③这样设计的主要节(电)能之处在于(写出2处)、。
③这样设计的主要节(电)能之处在于(写出2处)、。
镓(Ga)、锗( Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途。已知砷化镓的晶胞结构如图。试回答下列问题:
(1)下列说法不正确的是(选填序号)。
| A.砷化镓晶胞结构与NaCl相同 |
| B.第一电离能:Se >As> Ge> Ga |
| C.镓、锗、砷、硒都属于p区元素 |
| D.半导体GaP、SiC与砷化镓为等电子体 |
(2)砷化镓是将(CH3)3Ga和AsH3反应制备得到,该反应在700℃进行,反应的方程式为,AsH3空间形状为 。
(3)Ge的核外电子排布式为 ,H2 Se中硒原子的杂化方式为。
(4)AsH3沸点比NH3低,其原因是:。
天然气、煤炭气(CO、H2)的研究在世界上相当普遍。其中天然气和二氧化碳可合成二甲醚,二甲醚与水蒸气制氢气作为燃料电池的氢能源,比其他制氢技术更有优势。主要反应为:
①CH3OCH3(g) +H2O(g) 2CH3OH(g)△H= 37Kj·mol-1
2CH3OH(g)△H= 37Kj·mol-1
②CH3OH(g)+H2O(g)  3 H2(g)+CO2(g)△H =49Kj·mol-1
3 H2(g)+CO2(g)△H =49Kj·mol-1
③CO2(g) +H2(g)  CO(g) +H2O(g)△H=41.3Kj·mol-1
CO(g) +H2O(g)△H=41.3Kj·mol-1
其中反应③是主要的副反应,产生的CO对燃料电池Pt电极有不利影响。
请回答下列问题:
(1)二甲醚可以通过天然气和CO2合成制得,该反应的化学方程式为。
(2)CH3OCH3(g)与水蒸气制氢气的热化学方程式为 。
(3)下列采取的措施和解释正确的是。(填字母序号)
A.反应过程在低温进行,可减少CO的产生
B.增加进水量,有利于二甲醚的转化,并减少CO的产生
C.选择在高温具有较高活性的催化剂,有助于提高反应②CH3OH的转化率
D.体系压强升高,虽然对制取氢气不利,但能减少CO的产生
(4)煤炭气在一定条件下可合成燃料电池的另一种重要原料甲醇,反应的化学方程式为:
CO (g) +2H2(g)  CH3OH(g)△H <0。现将l0mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(
CH3OH(g)△H <0。现将l0mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(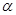 )与温度、压强的关系如下图所示。
)与温度、压强的关系如下图所示。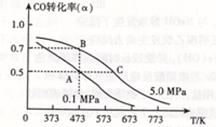
①自反应开始到达平衡状态所需的时间tAtB(填“大于”、“小于”或“等于”)。
②A、C两点的平衡常数KAKC(填“大于”、“小于”或“等于”)。
(5)某工作温度为650oC的熔融盐燃料电池,是以镍合金为电极材料,负极通人煤炭气(CO、H2),正极通人空气与CO2的混合气体,用一定比例的Li2CO3和Na2CO3混合物做电解质。请写出正极的电极反应式____。
某化合物A的结构简式为: ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3)。C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3)。C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物A中有三个含氧官能团,它们的名称分别是羧基、羟基和。
(2)化合物B能发生下列哪些类型的反应。
a.取代反应 b.加成反应 c.缩聚反应 d.消去反应
(3)化合物C能经下列反应得到G(分子式为C8H6O2,分子内含有五元环);
已知:(Ⅰ)RCOOH  RCH2OH
RCH2OH
(Ⅱ)R-Br  R-COOH
R-COOH
①确认化合物C的结构简式为。
②F→G反应的化学方程式为。
③化合物E有多种同分异构体,1H核磁共振谱图表明,其中某些同分异构体含有苯环,且苯环上有两种不同化学环境的氢,写出这些同分异构体中任意二种的结构简式。
(4)写出以苯乙烯( )为主要原料制备
)为主要原料制备 的合
的合
成路线流程图(无机试剂任选)。合成路线流程图示例如下:
CH3CH2OH H2C=CH2
H2C=CH2 H2CBr—CH2 Br
H2CBr—CH2 Br
无水AICl3可用作有机合成的催化剂,食品膨松剂等。工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水AlCl3的流程如下:
(1)在焙烧炉中发生反应:①Fe2O3(S) +3C(s) 2Fe(s) +3CO(g);
2Fe(s) +3CO(g);
②3CO(g)+Fe2O3(s) 2Fe(s)+3CO2(g).
2Fe(s)+3CO2(g).
则反应②的平衡常数的表达式为K= 。
(2)Al2O3、Cl2和C在氯化炉中高温下发生反应,当生成1molAlCl3时转移mol电子;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为:。
(3)升华器中发生反应的化学方程式为 。
(4)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱去结晶水制备无水AICl3,此反应必须在氯化氢的气流中加热,其原因是。
已知SOCl2为无色液体且极易与水反应生成HC1和SO2,AlC13·6H2O与SOCl2混合加热可制取无水AlCl3,写出该反应的化学方程式:。
A-G均为有机化合物,其中A为二卤代烃,相对分子质量为216,碳的质量分数为22.2%。相关转化关系如下: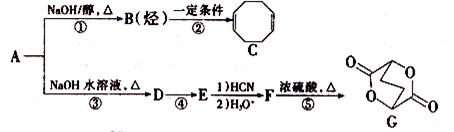
已知:
请回答:
(1)C的核磁共振氢谱有_______个吸收峰。
(2)①、④的反应类型分别为________、______。
(3)下列关于F的说法正确的是_______ (填选项字母)。
a.1 mol F与足量金属钠反应最多生成2 mol H2
b.1 mol F完全燃烧消耗8.5 mol O2
c.能与新制Cu(OH)2反应生成砖红色沉淀
d.能与NaHCO3反应生成CO2
(4)写出下列反应的化学方程式
反应③___________________________________;
反应⑤___________________________________
(5)符合下列条件的同分异构体有_______种,任写其中一种的结构简式_______。
i.与E互为同系物ii.相对分子质量比E大28