(5分)已知25 ℃、101 kPa时,一些物质的燃烧热为:
| 化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
| ΔH/( kJ·mol-1) |
-283.0 |
-285.8 |
-726.5 |
请回答下列问题:
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:________________。
(2)根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)==CH3OH(l) ΔH=___________。
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)利用如图装置,可以模拟铁的电化学防护。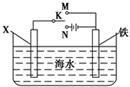
若X为碳棒,为减缓铁的腐蚀,开关K应置于________处。若X为锌,开关K置于M处,该电化学防护法称为__________________。
(2)以下为铝材表面处理的一种方法:
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是_________________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的________。
a.NH3 b.CO2 c.NaOHd.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为_________________。
取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是____________________。
(3)镀铜可防止铁制品腐蚀,电镀时阳极材料为________________,用铜而不用石墨作阳极的原因是______________________。
某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。
请回答:
I.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是 (填字母序号)。
| A.铝 | B.石墨 | C.银 | D.铂 |
(2)N极发生反应的电极反应式为 。
(3)实验过程中,SO42- (填“从左向右”、“从右向左”或“不”)移动;
滤纸上能观察到的现象有 。
II.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。电解过程中,Y极发生的电极反应为Fe-6e-+8OH-==FeO42-+4H2O 和 。
(5)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:
已知:NaBH4常温下能与水反应,可溶于异丙胺(沸点:33℃)。
(1)NaBH4中H元素的化合价为 。
请配平第①步反应的化学方程式,并用单线桥标出电子转移的方向和数目:
□NaBO2+□SiO2+□Na+□H2 □NaBH4+□Na2SiO3
□NaBH4+□Na2SiO3
(2) 实验室取用少量金属钠需要用到的实验用品有 、滤纸、玻璃片和小刀等。
在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是 。
(3)第②步分离采用的方法是 。
第③步分出NaBH4并回收溶剂,采用的方法是 。
(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和氢气(g),在25℃,101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是 。
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。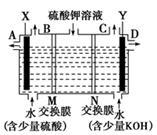
(1)X极与电源_________(填“正”或“负”)极相连,氢气从_________(填 “B” 或“C” )口导出。
(2)离子交换膜只允许一类离子通过,则M为__________交换膜(填“阴离子”或“阳离子”,下同),N为_________交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为_____________________。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是_________,转移的电子数为________________。
3.01×1023个氨分子(NH3)含__________mol氨分子,____________mol氢原子,__________mol质子_____________个电子。