煤的气化产物CO和H2是重要的化工原料。某些简单的有机物和CO反应合成具有优良性能材料的基本过程如图所示。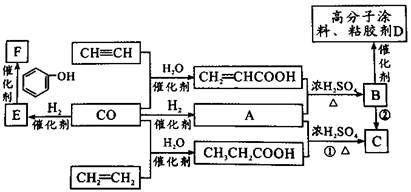
已知:①E由CO和H2按物质的量之比为1:1完全反应而成;
②A由CO和H2按物质的量之比为1:2完全反应而成。
回答下列问题:
(1)E的结构简式 ;B中的官能团名称 。
(2)下列说法不正确的是 。
A.HC CH可以与氯化氢反应,得到氯乙烯 CH可以与氯化氢反应,得到氯乙烯 |
| B.CH2=CH2可由石油裂化得到,一定条件下可制得聚乙烯塑料 |
| C.由B生成D的反应类型是加聚反应 |
| D.可用溴水鉴别CH3CH2COOH与CH2=CHCOOH |
(3)写出反应①的化学方程式 ,属于 反应。
对于下列芳香族化合物,命名与结构简式都正确的是( )
(1)主链含5个碳原子,有两个甲基作支链的烷烃有________________种;其中两种
的结构简式是: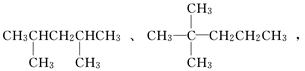 试写出其他几种
试写出其他几种
分子的结构简式,并用系统命名法命名.
________________________________________________________________________
________________________________________________________________________.
(2)以上分子中有一种分子是由烯烃加成得到,而且分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称________________________________________________.
写出下列物质的结构简式:
(1)2,4,6三甲基辛烷__________________________________________________;
(2)3甲基1丁炔 ____________________________________________________;
(3)间甲乙苯_________________________________________________________;
(4)苯乙烯___________________________________________________________.
某化合物的分子式为C5H11Cl,分析数据表明:分子中含有两个—CH3,两个—CH2—,一个CH和一个 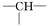 ,写出它可能的结构简式 ______________________
,写出它可能的结构简式 ______________________
已知下列有机物:
①CH3—CH2—CH2—CH3和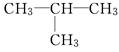
②CH2===CH—CH2—CH3和CH3—CH===CH—CH3
③CH3—CH2—OH和CH3—O—CH3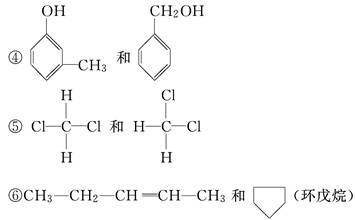
⑦CH2===CH—CH===CH2和CH3—CH2—C≡CH
(1)其中属于同分异构体的是________________.
(2)其中属于碳链异构的是________________.
(3)其中属于位置异构的是________________.
(4)其中属于官能团异构的是________________.
(5)其中属于同一种物质的是________________.