为了证明硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]晶体的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是
| A.取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+ |
| C.取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D.取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+ |
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开。S-诱抗素的分子结构如图,下列关于该分子说法正确的是()
| A.1 mol S-诱抗素的分子能与2molNaOH反应 |
| B.能发生加成、取代、消去反应 |
| C.S-诱抗素的分子式为C14H19O4 |
| D.含有碳碳双键、苯环、羟基、羰基、羧基 |
下列物质中不与NaOH溶液反应的是 ( )
①酚酞②Fe③SiO2④蛋白质⑤Cl2⑥NaHCO3⑦NO2⑧CH3COOC2H5
| A.①②④ | B.①②④⑦⑧ | C.②④ | D.② |
一化学兴趣小组在家中进行化学实验,按照图甲连接好线路发现灯泡不亮,按照图乙连接好线路发现灯泡亮,由此得出的结论正确的是 ( )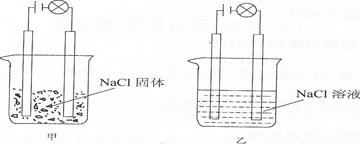
| A.NaCl是非电解质 |
| B.NaCl溶液是电解质 |
| C.NaCl在水溶液中电离出可以自由移动的离子 |
| D.NaCl溶液中水电离出大量的离子 |
维生素C(Vitamin C)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食 品添加剂,其结构如右图。下列有关说法中正确的是()
品添加剂,其结构如右图。下列有关说法中正确的是()
A.维生素C的分子式为C6H10O6
B.维生素C 由于含有酯基而难溶于水
C.维生素C由于含有C=O键而能发生加成反应
D.维生素C的酸性可能是③、④两个羟基引起的
表1中实验操作能达到实验目的的是()
| 实验操作 |
实验目的 |
|
| A |
将乙烷与乙烯分别通入酸性高锰酸钾溶液中 |
可以鉴别乙烷和乙烯 |
| B |
蔗糖溶液加入稀硫酸,在加入新制氢氧化铜,加热 |
确定蔗糖是否水解 |
| C |
向酒精和醋酸的混合液中加入金属钠 |
确定酒精中混有醋酸 |
| D |
向苯中加入酸性高锰酸钾溶液 |
验证 苯结构中存在碳碳双键 苯结构中存在碳碳双键 |