在一定条件下,单质B、C、D、E都能与A单质发生化合反应,转化关系如图所示。已知:①G是黑色晶体,能吸附B单质;②H能与氢氧化钠溶液或盐酸反应;③实验时在G和C的混合物表面加入某强氧化剂粉末,在表面上插入一根除去氧化膜的E片,点燃E引发G与C的反应;④I是绿色植物光合作用的原料,温室中常用它作肥料。根据上述信息,回答下列问题: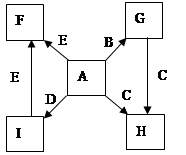

(1)I的电子式为 ,G的俗名是 。
(2)以C和E为电极在NaOH溶液中构成原电池,该原电池的负极反应式为 。
(3)根据E和A反应的能量变化图像写出热化学方程式: 。
(4)两种常见含C元素的盐,一种pH>7,另一种pH<7,写出这两种溶液混合时发生反应的离
子方程式:
(5)写出B在高温下和水蒸气反应的化学方程式并标出电子转移方向和总数 。
1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g) 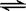 Na2S(s) + 4H2O(g) 。
Na2S(s) + 4H2O(g) 。
(1)该反应的平衡常数表达式为____________________。
已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。 (2)该温度下,在2L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。则5分钟内H2的平均反应速率为_________________。
(2)该温度下,在2L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。则5分钟内H2的平均反应速率为_________________。
(3)能说明该反应已达到平衡状态的是______(填序号)。
a.容器内压强保持不变 b.容器内气体密度保持不变
c.c(H2) = c(H2O) d.υ正(H2) =υ逆(H2O)
(4)向平衡体系中加入焦炭,下列图像正确的是___________(填序号)。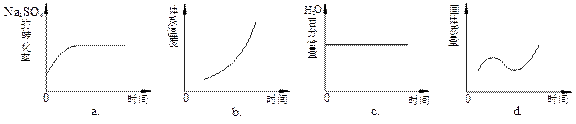
(5)用有关离子方程式说明上述反应产物水溶液的酸碱性______________________________,欲使该溶液中S2—浓度增大,平衡逆向移动,可加入的物质是____________________。
作为世界卫生组织(WHO)推荐的A1级广谱、安全、高效消毒剂,二氧化氯(ClO2)在水处理领域有着广泛应用。与氯气相比,它不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。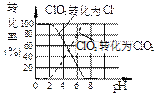
(1)反应时,ClO2生成ClO2—、Cl—的转化率与溶液的pH的关系如图所示。则pH= 8时,ClO2被还原为_____________。
(2)亚氯酸根离子(ClO2—)对人体不利。欲在弱碱性条件下将水中的ClO2—转化为Cl—除去,若该反应体系中的物质有:NaClO2、Fe(OH)3、NaHCO3、FeCl2、NaCl、H2O、CO2。写出、配平有关化学方程式,并标出电子转移的方向和数目:
__________________________________________________________________ ___________。
___________。
(3)以下是ClO2的两种制备方法:
方法一:2NaClO3 + 4HCl → 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O
方法二:2NaClO3 + H2O2 + H2SO4 → 2ClO2↑+ O2↑+ Na2SO4 + 2H2O
①方法一,当有0.2mol电子 发生转移时,参与反应的还原剂为_________ mol。
发生转移时,参与反应的还原剂为_________ mol。
②方法二:该反应中H2O2_________(填序号)。
a.发生氧化反应 b.仅做氧化剂 c.既被氧化又被还原 d.既未被氧化也未被还原
③用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是___________________。
组成生命细胞的11种宏量元素(约占人体总质量的99.97%),全部位于周期表的前20号。其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素。
(1)这六种元素中除H、C、O、P、S外,应该还有______(写元素符号),它的原子最外层共有______种不同运动状态的电子;与它同周期,且单质熔点最高的元素在周期表中的位置_______________________。
(2)糖类是人体获得能量的来源之一。已知1mol 葡萄糖在人体内完全氧化为二氧化碳和水,放出2804 kJ的热量,该反应的热化学方程式_______________________________________。
(3)CO2是一种温室气体,它的电子式为______________,将其转变其他化工原料,必须破坏的化学键属于_________(填“极性”或“非极性”)键。
(4)元素周期表中元素的性质存在递变规律,下列关系正确的是______(填序号)。
a.离子半径:S2—>Na+>O2—>H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原 性:PH3>H2S>HCl>HF
性:PH3>H2S>HCl>HF
(5)下表为部分非金属元素与氢形成共价键的键长与键能数据:
| 共价键 |
H-H |
H-F |
H-Cl |
H-Br |
H-O |
H-S |
H-N |
H-P |
| 键长(pm) |
74 |
92 |
127 |
141 |
98 |
135 |
101 |
321 |
| 键能(kJ/mol) |
436 |
568 |
432 |
368 |
464 |
364 |
391 |
142 |
根据表中数据,归纳共价键键能与键长的关系_______________________________________。
已知A是卤代烃,C是高分子化合物,H是一种环状酯。转化关系如下衅所示。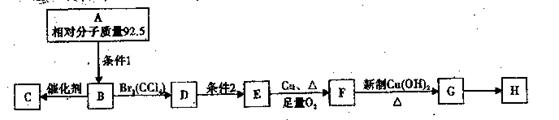
回答下列问题:
(1)A的分子式;D越的反应类型:,条件1是。
(2)写出E、H的结构简式:E,H。
(3)写出下列反应的化学方程式:
B→C:;F→G:。
(4)满足下列条件的G的同分异构体有种。
①属于酯类;②能发生银镜反应;③能与金属钠反应放出气体。
硫酸亚铁蓉易被氧化,而硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。
现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:
Fe+H2SO4(稀)FeSO4+H2↑
FeSO4+(NH4)2SO4+6H2O(NH4)2SO4·FeSO4·6H2O
步骤l:在盛有适量铁屑的锥形瓶审加入某种试剂除去油污,加热,充分反应后过滤、洗涤、干燥、称量,铁屑质量为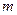 。
。
步骤2:将处理过的铁屑加入到一定量的稀H2SO4中,加热至50℃—80℃充分反应,趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣于燥后称重,剩余铁屑质量为 。
。
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌使之溶解,缓缓加热一段时间,将其冷却气结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所得晶体质量为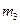 。
。
回答下列问题:
(1)能够甩于除去铁屑表面油污的试剂是(填字母)。
| A.纯碱溶液 | B.烧碱溶液 | C.明矾溶液 | D.稀硫酸 |
(2)实验中三次用到过滤操作,完成该操作的玻璃仪器有。
步骤2中趁热过滤的目的是。
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质(碱式硫酸铁),该反应的化学方程式为。
(4)铁屑表面常有少量的铁锈(Fe2O3·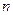 H2O),对FeSO4的制备(填“有”、“无”)影响,理由是(用离子方程式回答)。
H2O),对FeSO4的制备(填“有”、“无”)影响,理由是(用离子方程式回答)。
(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵晶体的产率为。
(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水(简述实验操作、现象和结论)。
。