某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中的溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,当HA浓度为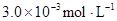 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
| 25℃平衡体系 |
平衡常数 |
焓变 |
起始总浓度 |
在水中,HA 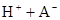 |
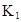 |
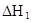 |
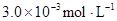 |
在苯中,2HA 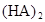 |
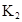 |
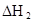 |
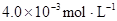 |
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1=___________。
(2)25℃,该水溶液的pH为___________,(已知:1g2=0.3,lg3=0.5)在苯体系中HA的转化率为___________。
(3)在苯中,HA发生二聚:2HA (HA)2,反应在较低温度下自发进行,则
(HA)2,反应在较低温度下自发进行,则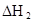 ___________0。
___________0。
(4)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足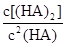 =130,则反应向___________方向进行。
=130,则反应向___________方向进行。
聚碳酸酯无色透明,具有优异的抗冲击性,能用于制造宇航员的面罩、智能手机机身外壳等。双酚化合物是合成聚碳酸酯的单体之一,某种双酚化合物G的合成路线如下:
(1)G中所含的官能团有________________;B的核磁共振氢谱有 个峰。
(2)写出反应类型:反应 ① ___________;反应 ③ ____________。
(3)写出A的名称 ______________;F的结构简式 ______________。
(4)写出反应 ④ 的化学方程式_______________________________________。
(5)C有多种同分异构体,写出同时满足下列条件的同分异构体的结构简式_____________。
(I)属于α-氨基酸,且苯环上有三个互为间位的取代基
(II)与FeCl3溶液作用无显色现象
(III)1 mol该同分异构体与足量NaOH溶液反应时,最多能消耗3 mol NaOH
有机物A的分子式为C9 H10 O2,A在光照条件下生成的一溴代物B,可发生如下转化关系(无机产物略):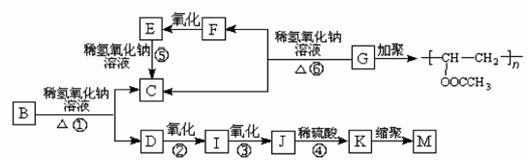
其中K物质与氯化铁溶液发生显色反应,且环上的一元取代物只有两种结构。
已知:①当羟基与双键碳原子相连时,易发生如下转化:RCH=CHOH→RCH2CHO;
② —ONa连在烃基上不会被氧化。
请回答下列问题:
(1)F与I中具有相同的官能团,检验该官能团的试剂是 。
(2)上述变化中属于水解反应的是 (填反应编号)。
(3)写出结构简式,G: ,M: 。
(4)写出下列反应的化学方程式:反应①: ,K与少量的氢氧化钠溶液反应: 。
(5)同时符合下列要求的A的同分异构体有 种。
I.含有苯环Ⅱ.能发生银镜反应和水解反应
Ⅲ.在稀氢氧化钠溶液中,1mol该同分异构体能与1mol NaOH反应
水杨酸酯E为紫外线吸收剂,可用于配制防晒霜。E的一种合成路线如下: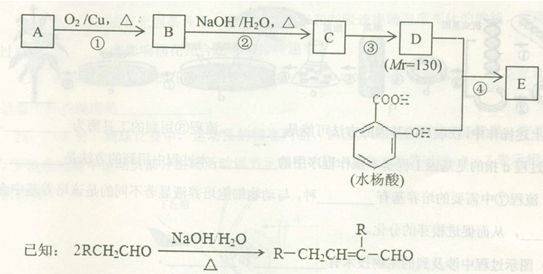
请回答下列问题:
(1)A是分子式为C4H10O的一元醇,分子中只有一个甲基。F与A互为同分异构体,F的核磁共振氢谱图有2组峰,且峰面积比为9:1。则F与浓HBr溶液共热生成有机物的结构简式为 。
(2)B能与新制的Cu(OH)2悬浊液发生反应,该反应的化学方程式为 。
(3)C中所含官能团的名称为 ,若要检验C中所含官能团,一次取样检验,按使用试剂的先后顺序,下列选项中组 (填字母编号)更为合理。
a.银氨溶液、溴水 b.溴水、银氨溶液
c.银氨溶液、稀盐酸、溴水 d.溴水、氢氧化钠溶液、银氨溶液
(4)第③步的反应类型为 。
(5)同时符合下列条件的水杨酸的同分异构体有 种。
a.分子中含有6个碳原子在同一条直线上
b.分子中所含官能团包括水杨酸具有的含氧官能团
共聚法可改进有机高分子化合物的性质,高分子聚合物P的合成路线如下: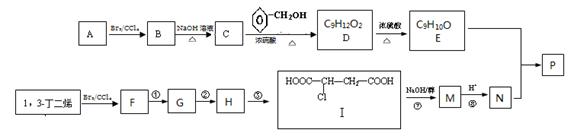
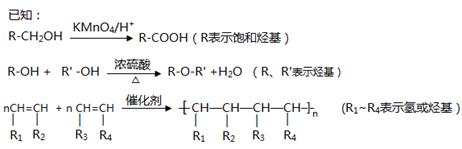
(1)A的结构式为________________ ,C的名称为
(2)D中含有的官能团的名称
(3)由F经①~③合成I,F可以使溴水褪色.反应①的化学方程式是 。
反应②的反应类型是 反应③的反应试剂是 。
(4)下列说法正确的是 。
a.C可与水任意比例混合
b.A与1,3-丁二烯互为同系物
c.由I生成M时,1mol I最多消耗3molNaOH
d.N不存在顺反异构体
(5)写出由D生成E的化学方程式 。
(6)E与N等物质的量发生共聚反应生成P,则P的结构简式为 。
(7)E有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式 。
a.苯环上有两个取代基
b.能使FeCl3液显紫色
c.1mol该有机物与浓溴水反应时能消耗4molBr2
化学将对人类解决资源问题作出重大贡献。
乙基香草醛( )是食品添加剂的增香原料,其香味比香草醛更加浓郁。
)是食品添加剂的增香原料,其香味比香草醛更加浓郁。
(1)写出乙基香草醛分子中的含氧官能团的名称:醛基、 ;
(2)乙基香草醛不能发生下列反应中的 (填序号);
①氧化②还原③加成④取代⑤消去⑥显色⑦加聚
(3)乙基香草醛有多种同分异构体,写出符合下列条件乙基香草醛所有同分异构体的结构简式 ;
①属于酯类②能与新制氢氧化铜加热后反应生成红色沉淀
③苯环上有两个处于对位的取代基,其中一个是羟基
(4)尼泊金乙酯是乙基香草醛的一种同分异构体,可通过以下过程进行合成: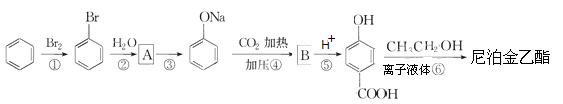
(a)写出A和B的结构简式:A ,B ;
(b)写出第⑥歩反应的化学方程式 。