为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验方案,其中符合实验要求且完全正确的是
| |
实验操作 |
实验现象 |
离子反应 |
实验结论 |
| A |
在氯化亚铁溶液中滴加新制氯水 |
浅绿色溶液变成棕黄色溶液 |
2Fe2++Cl2= 2Fe3++2Cl- |
Fe2+具有还原性 |
| B |
在氯化亚铁溶液中加入锌片 |
浅绿色溶液变成无色溶液 |
Fe2++Zn= Fe+Zn2+ |
Zn具有还原性 |
| C |
在氯化铁溶液中加入铁粉 |
棕黄色溶液变成浅绿色溶液 |
Fe3++Fe= 2Fe2+ |
铁单质具有还原性 |
| D |
在氯化铁溶液中加入铜粉 |
蓝色溶液变成棕黄色溶液 |
2Fe3++Cu= 2Fe2++Cu2+ |
Fe3+具有氧化性 |
某温度下,反应H2(g)+I2 (g) 2HI(g);ΔH<0,在带有活塞的密闭容器中达到平衡,下列说法中正确的是()
| A.体积不变,升温,正反应速率减小 |
| B.温度、压强均不变,充入HI气体,开始时正反应速率增大 |
| C.温度不变,压缩气体的体积,平衡不移动,颜色加深 |
| D.体积、温度不变,充入氮气后,容器内压强增大,正逆反应速率都增大 |
NO和CO都是汽车尾气里的有害物质,它们能缓慢地起反应生成N2和CO2,下列对此反应的叙述正确的是()
| A.使用催化剂不能改变反应速率 |
| B.降低压强能使反应速率加快 |
| C.改变压强对反应速率没有影响 |
| D.升高温度能加快反应速率 |
在容积固定的密闭容器中充入一定量的X、Y两种气体,一定条件下发生可逆反应3X(g)+Y(g) 2Z(g),并达到平衡。已知正反应是放热反应,测得X的转化率为37.5%,Y的转化率为25%,下列有关叙述正确的是()
2Z(g),并达到平衡。已知正反应是放热反应,测得X的转化率为37.5%,Y的转化率为25%,下列有关叙述正确的是()
| A.若X的反应速率为0.2 mol·L-1·s-1,则Z的反应速率为0.3 mol·L-1·s-1 |
| B.若向容器中充入氦气,压强增大,Y的转化率提高 |
| C.升高温度,正反应速率减小,平衡向逆反应方向移动 |
| D.开始充入容器中的X、Y物质的量之比为2∶1 |
可逆反应:2X+Y 2Z(气);ΔH<0,气体的平均摩尔质量M随温度变化如图所示,则下列说法正确的是()
2Z(气);ΔH<0,气体的平均摩尔质量M随温度变化如图所示,则下列说法正确的是()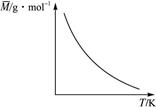
图2-58
| A.X和Y可能都是固体 |
| B.X和Y一定都是气体 |
| C.若Y为固体,X一定是气体 |
| D.X和Y不可能都是气体 |
将3 molO2加入到V L的反应器中,在高温下放电,经t1s建立了平衡体系:3O2 2O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是()
2O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是()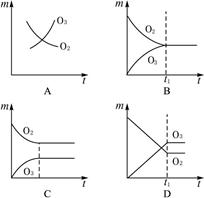
图2-57