在一密闭容器中,反应m A(g)+n B(g) 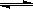 3 C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.20mol/L。下列判断中正确的是
3 C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.20mol/L。下列判断中正确的是
A.A的质量分数减小 B.化学计量数:m+n >3
C.平衡向右移动 D.物质C的体积分数减小
15.化学反应可视为旧键断裂和新键形成的过程。共价键的键能是两种原子间形成1mol共价键(或其可逆过程)时释放(或吸收)的能量。已知H-H 键的键能为436kJ·mol-1 ,Cl-Cl键的键能为243 kJ·mol-1,H-Cl键的键能为431 kJ·mol-1 ,则H2 (g ) + Cl2 (g ) ="=" 2HCl(g ) 的反应热(△H )等于
| A.-183 kJ·mol-1 | B.183 kJ·mol-1 |
| C.-862 kJ·mol-1 | D.862 kJ·mol-1 |
14.热化学方程式C(s)+H2O(g)= CO(g)+H2(g)△H =+131.3kJ/mol表示
| A.碳和水反应吸收131.3kJ能量 |
| B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量 |
| C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ |
| D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ |
13.将硬脂酸甘油酯与NaOH溶液共热进行皂化反应,能把硬脂酸钠和甘油从混合物中分离出来的操作有:①盐析;②过滤;③蒸馏;④分液。其中正确的组合是
| A.①②③ | B.①③④ | C.②③④ | D.①②③④ |
12.由乙烯推测丙烯(CH3CH=CH2)的结构或性质正确的是
| A.分子中3个碳原子在同一直线上 |
| B.分子中所有原子在同一平面上 |
| C.与氯化氢加成只生成一种产物 |
| D.能发生加聚反应 |
11.检验无水乙醇中是否有水的方法是
| A.加金属钠 | B.加入无水硫酸铜 |
| C.加热蒸馏 | D.加无水氯化钙 |