铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提炼Al2O3并制取铝的流程如下: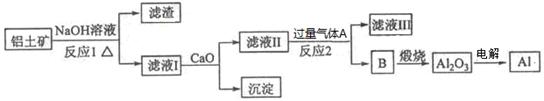
请回答下列问题:
(1)铝与NaOH溶液反应的离子方程式为 。
(2)图中涉及分离溶液与沉淀的玻璃仪器有烧杯、玻璃棒、_________。
(3)反应1涉及的化学方程式有 、 。滤液Ⅰ中加入CaO生成的沉淀是_ (填化学式)。
(4)向滤液Ⅱ中通入气体A为 ,生成沉淀B的离子方程式为 。
水是自然界中普遍存在的一种物质,根据下列信息回答问题:
(1)已知H3O+ + OH- = 2H2O,H3O+的立体构型是_________,中心原子的杂化类型是_______。
(2)在OH-、H2O、H3O+、H2O2中均含有的化学键是
A、极性键 B、非极性键 C、配位键
(3)在20℃,1.01×105Pa,水可以结成冰,称为热冰。下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是
A、金刚石 B、干冰 C、食盐 D、固态氨
砷原子的最外层电子排布式是4s24p3,砷元素在周期表中的位置;其最高价氧化物的化学式为,砷酸钠的化学式是。
(1)苯、四氯化碳、乙醇、汽油是常见的有机溶剂,能与水互溶的是________;不溶于水,且密度比水大的是________.
(2)一瓶无色气体,可能含有CH4和CH2=CH2,或其中的一种,与一瓶Cl2混合后光照,观察到黄绿色逐渐褪去,瓶壁有少量无色油状小液滴。
①由上述实验现象推断出该瓶气体中一定含有CH4,你认为是否正确,为什么?
②上述实验中可能涉及的反应类型有___________
立方烷是新合成的一种烃,其分子呈立方体结构,如图所示.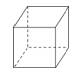
(1)立方烷的分子式为
(2)其一氯代物共有种
(3)其二氯代物共有种
在通常情况下,多个羟基连在同一个碳原子上的分子结构是不稳定的,容易自动失水生成碳氧双键结构:
下面是9种物质的转化关系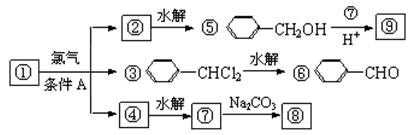
(1)化合物①是,它跟氯气发生反应的条件是。
(2)⑦的结构简式,化合物⑤跟⑦可在酸的催化下去水生成化合物⑨,⑨的结构简式是
(3)化合物⑨是重要的定香剂,香料工业上常用②和⑧直接合成它,此反应的化学方程式是。
(4)⑤的同分异构体很多种,写出其中属于不同类别芳香族化合物的两种同分异构体的结构简式、