气态废弃物中的硫化氢可用电化学的方法转化为可利用的硫:配制一份电解质溶液,主要成分为:K4[Fe(CN)6](200 g/L)和KHCO3(60 g/L);通电电解,通入H2S气体。过程中涉及硫化氢转化为硫的总反应:2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S,则下列说法不正确的是( )
| A.电解过程中的阳极反应为:[Fe(CN)6]2――e-=[Fe(CN)6]3- |
| B.电解过程中阴极附近溶液的pH降低 |
| C.电解过程中每处理l mol硫化氢气体,理论上转移电子2 mol |
| D.该处理方法理论上不需要补充电解质溶液 |
2007年2月,中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成N2和CO2。下列对此反应的叙述中正确的是( )。
| A.使用光催化剂不改变反应速率 |
| B.使用光催化剂能增大NO的转化率 |
| C.升高温度能加快反应速率 |
| D.改变压强对反应速率无影响 |
25℃时,水的电离达到平衡:
H2O + H2O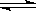 H3O+ + OH- ⊿H >0,
H3O+ + OH- ⊿H >0,
下列叙述正确的是 ()
| A.向水中加入稀氨水,平衡逆向移动,C(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,C(H+)增大,KW不变 |
| C.向水中加入少量固体Na,平衡正向移动,C(OH-) 降低 |
| D.将水加热,KW增大,pH不变 |
在一定条件下,对于反应:mA(g) + nB(g)  cC(g) +dD(g),C物质的质量分数(C%)与温度、压强的关系如图所示,下列判断正确的是()
cC(g) +dD(g),C物质的质量分数(C%)与温度、压强的关系如图所示,下列判断正确的是()
| A.△H<0△S>0 |
| B.△H>0△S<0 |
| C.△H>0△S>0 |
| D.△H<0△S<0 |
18 g炭粉燃烧所得气体中CO占,CO2占;且C(s)+O2(g)===CO(g) ΔH=-110.35 kJ·mol-1, CO(g)+O2(g)===CO2(g) ΔH=-282.57 kJ·mol-1,与这些碳完全燃烧相比较,损失的热量是( )
| A.196.46 kJ | B.55.175 kJ |
| C.141.285 kJ | D.282.57 kJ |
下列条件能加快反应速率,且反应物活化分子百分数增加的是()
①升高温度②使用正催化剂③增大压强④增加浓度
| A.②④ | B.③④ | C.①② | D.②③ |