下列根据实验操作和现象所得出的结论或相应的解释错误的是
| 选项 |
实验操作 |
实验现象 |
结论或解释 |
| A |
向盛有0.5mol•L-1 Fe(NO3)2溶液的试管中加入0.5mol•L-1 H2SO4溶液 |
在试管口处出现红棕色气体 |
溶液中NO3-被Fe2+还原为NO2 |
| B |
向PbI2饱和溶液中滴加几滴0.1mol•L-1 KI溶液 |
出现黄色沉淀 |
说明 PbI2饱和溶液中有Pb2+存在 |
| C |
向白色ZnS沉淀上滴加0.1mol•L-1 CuSO4溶液,振摇 |
沉淀变为黑色 |
ZnS沉淀转化为CuS沉淀 ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq) |
| D |
用1mol•L-1醋酸溶液和1mol•L-1盐酸分别做导电性实验 |
醋酸溶液对应的灯泡较暗 |
醋酸是弱电解质 |
近两年流行喝苹果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品。苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结
构式为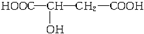 ,下列说法不正确的是( )
,下列说法不正确的是( )
| A.苹果酸在一定条件下能发生酯化反应 |
| B.苹果酸在一定条件下能发生催化氧化反应 |
| C.苹果酸在一定条件下能发生加成反应 |
| D.1 mol苹果酸与Na2CO3溶液反应最多生成2 mol CO2 |
某气态烃在一个密闭容器中和过量的氧气混合完全燃烧,反应后测得容器内压强不变(温度为120℃),此气态烃为()
| A.CH4 | B.C2H4 | C.C3H6 | D.C3H8 |
检验下列有机物的方法中正确的是( )
| A.向氯仿中加入AgNO3溶液检验其含有氯元素 |
| B.用酸性KMnO4溶液鉴别乙烯和乙炔 |
| C.用FeCl3溶液鉴别苯和苯酚 |
| D.用新制Cu(OH)2悬浊液鉴别乙醇、乙醛和乙酸 |
下列各组物质中最简式相同,但既不是同系物又不是同分异构体的是()
| A.丙烯和环丙烷 | B.甲醛和乙酸 | C.乙酸和甲酸甲酯 | D.乙醛和乙酸乙酯 |
现有三组混合液:①乙酸乙酯和乙酸钠溶液②乙醇和丁醇③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A.分液、萃取、蒸馏 | B.萃取、蒸馏、分液 |
| C.分液、蒸馏、萃取 | D.蒸馏、萃取、分液 |