某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,某研究性学习小组欲分析其成分,实验记录如下图所示。
(1)该矿石中含有 (填化学式),请写出实验过程①中反应的离子方程式 。
(2)将氧化物Ⅱ在熔融状态下电解,可以得到某金属单质。当阳极上收集到气体33.6L(已折算成标准状况)时,阴极上得到该金属 g。
(3)试写出该金属与氧化物I反应的化学方程式 ;将该反应的产物加入到足量烧碱溶液中,请写出发生反应的离子方程式 。
(4)经进一步分析该矿石中还含有微量的SrCO3(上述方案检测不出)。锶(Sr)为第五周期ⅡA族元素。下列叙述正确的是 (填序号)。
①氯化锶(SrCl2)溶液显酸性
②SrSO4难溶于水
③工业上可以用电解SrCl2的水溶液制取金属锶(Sr)
④高纯六水氯化锶晶体(SrCl2·6H2O)必须在HCl氛围中加热才能得到SrCl2
已知 X、Y、Z、W是原子序数依次增大的四种短周期元素,Y元素形成的化合物种类最多;W原子有2个未成对电子。X、Y、W三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。Q是第四周期元素,最外层只有一个电子,其余各层电子均充满。
请回答下列问题(用元素符号或化学式表示):
(1)元素Y、Z、W的基态原子的第一电离能由大到小的顺序为 。
(2)M分子中Y原子轨道的杂化类型为 。
(3)Q+的核外电子排布式为 ,下图是由W、Q形成的某种化合物的晶胞结构示意图,该晶体的化学式 。(黑球代表Q原子)
(4)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
(5)Z2X4在碱性溶液中能够将QW还原为Q2W,已知当1mol Z2X4完全参加反应时转移了4 mol电子,则该反应的化学方程式可表示为: 。
(6)一种处理汽车尾气中ZW、YW的方法是在催化剂作用下使两者反应成无污染的气态。已知反应生成1gZ的单质时放出4.3kJ热量。此反应的热化学方程式为 。
选考【化学—选修5有机化学基础】高分子材料PET聚酯树脂和PMMA的合成路线如下:
已知:
Ⅰ.RCOOR′+ R′′18OH RCO18O R′′+ R′OH(R.R′.R′′代表烃基)
RCO18O R′′+ R′OH(R.R′.R′′代表烃基)
Ⅱ. (R.R′代表烃基)
(R.R′代表烃基)
(1)①的反应类型是________。
(2)②的化学方程式为________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________。
(5)G的结构简式为________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d.1 mol 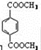 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是________。
(8)写出由PET单体制备PET聚酯(化学式为C10nH8nO4n 或C10n+2H8n+6O4n+2)并生成B的化学方程式 。
选考【化学——选修3物质结构与性质】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 ,另一种的晶胞如图二所示,该晶胞的空间利用率为 (保留两位有效数字)。( )
)
(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出上述过程的离子方程式 。
选考【化学——选修2化学与技术】水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)水的净化和软化的区别是________。
(2)①生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行杀菌消毒、混凝沉淀、过滤等工艺处理,这三项处理的正确顺序是_________。
②下列试剂能够用来对自来水进行杀菌消毒,且不会造成二次污染的是_______填字母)。
a.福尔马杯 b.漂白粉 c.氯气 d.臭氧
(3)Na2FeO4是一种新型水处理剂,工业上可用FeSO4制备Na2FeO4其工艺流程如下:
①工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加人绿矾。请解释这一做法的原因:________________________。(用必要的离子方程式和文字描述)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式:____________。
(4)石灰纯碱法是常用的硬水软化方法,已知25℃时Ksp(CaCO3)=2.8×10-9,现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为5.6×10-5mol/L,则生成沉淀所需Ca(OH)2溶液的最小浓度为____________。
制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得第一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表,请依据表中数据解释下列问题:
| CaSO4 |
Mg2(OH)2CO3 |
CaCO3 |
BaSO4 |
BaCO3 |
| 2.6×10-2 |
2.5×10-4 |
7.8×10-4 |
2.4×10-4 |
1.7×10-3 |
①过程Ⅰ选用BaCl2而不选用CaCl2的原因为___________________________________。
②过程II之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,原因是____________。
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下: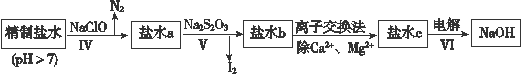
①过程Ⅳ除去的离子有______、_______。
②盐水b中含有SO42-。Na2S2O3将IO3- 还原为I2的离子方程式是___________________________。
③过程VI中,产品NaOH在电解槽的______区生成(填“阳极”或“阴极”),该电解槽为______离子交换膜电解槽(填“阳”或“阴”)。