选考【化学——选修3物质结构与性质】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 ,另一种的晶胞如图二所示,该晶胞的空间利用率为 (保留两位有效数字)。( )
)

(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出上述过程的离子方程式 。
按下图装置进行实验,并回答下列问题
(1)判断装置的名称:A池为
(2)锌电极反应式为__________________
石墨棒C1为______极,电极反应式为__________
石墨棒C2附近发生的实验现象为______________
(3)当C2极析出2.24L气体(标准状态)时,锌的质量减少了__g.CuSO4溶液的质量增加了______g
(1)某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。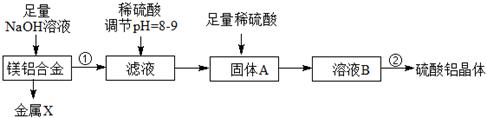
则镁铝合金中加NaOH溶液的化学反应方程式为,金属X是,
固体A的化学式,操作②包含的步骤有蒸发浓缩、、过滤、干燥。
(2)某兴趣小组为测定镁铝合金中各组成的质量分数,设计图示装置。则仪器甲的名称,需要测定的数据有。(已知该实验时的温度压强)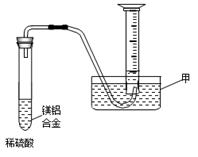
(3)现有一定量的AlCl3和FeCl3混合溶液,已知其中Al3+、Fe3+的物质的量之和为0.10 mol,若向此溶液加入170 mL 2mol/L NaOH溶液,设Al3+物质的量与总物质的量的比值为x。则x=0.4时,沉淀的物质的量为mol。请在图中画出沉淀总量(y mol)随x(0→1)变化曲线。
在下图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰。H可用于制造光导纤维,J是一种乳白色凝胶状沉淀。(部分生成物和部分反应条件未列出)
请回答下列问题:
(1)A的电子式为。
(2)H的化学式为。
(3)写出反应①的离子方程式。
(4)写出反应②的化学方程式。
(1)食品和药品关系人的生存和健康。
①市场上销售的食盐品种很多。下列食盐中,所添加的元素不属于人体必需微量元素的是(填字母)。
A.加钙盐 B.加碘盐 C.加锌盐
②纤维素被称为“第七营养素”。食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质。在化学分类中,纤维素属于(填字母)。
A.蛋白质 B.脂肪 C.多糖
③某同学感冒发烧,他可服用下列哪种药品进行治疗(填字母)。
A.麻黄碱 B.阿司匹林 C.抗酸药
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活。
① 在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其各成分金属的熔点。(选填“高”或“低”)
② 炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。铁锅的腐蚀主要是由腐蚀造成的。
③ 石英玻璃纤维又称光导纤维,其主要成分和NaOH溶液反应的离子方程式为
。有机玻璃受热时会软化,易于加工成型。有机玻璃是一种材料(选填“橡胶”或“纤维”或“塑料”)。
(3)防治环境污染,改善生态环境已成为全球的共识。
① pH<5.6的雨水称为酸雨,主要是由人为排放的硫氧化物和等酸性气体转化而成的。向煤中加入石灰石作为脱硫剂,可以减少煤燃烧时产生的SO2。发生反应的化学方程式为。
②NaNO2作为食品添加剂不能大量食用,因为它会与肉类中的蛋白质反应生成致癌的化合物。CO使人中毒是因为很容易和人体血液中的结合。
③城市餐饮业会产生大量污染环境的“地沟油”。综合利用“地沟油”的一种方法是将“地沟油”中的油脂水解以获取甘油和。生活中会产生大量废弃塑料,将废弃塑料进行处理,可以获得乙烯、丙烯等化工原料。
取20 mL NaOH溶液平均分成两份,分别放入A、B两支试管中。向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如下表所示:
| 盐酸体积(单位:mL) |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
| A产生CO2的体积 |
0 |
0 |
0 |
0 |
0 |
22.4 |
44.8 |
44.8 |
44.8 |
| B产生CO2的体积 |
0 |
0 |
22.4 |
44.8 |
67.2 |
89.6 |
x |
x |
x |
请回答下列问题
(1)少量CO2与NaOH溶液反应的离子方程式,
过量CO2与NaOH溶液反应的化学方程式;
(2)试管A中通入CO2后所得溶液的溶质为;
(3)原NaOH溶液的物质的量浓度为mol/L;
(4)滴加70mL盐酸时,A、B产生CO2的体积均为最大值,则x=mL。