有关FeSO4的转化关系如下图所示(无关物质已略去)。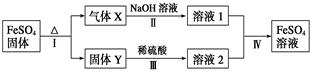
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。
②Y是红棕色的化合物。
(1)气体X的成分是_______________(填化学式),写出通入BaCl2溶液,产生白色沉淀的化学方程式______________________________。
(2)反应Ⅰ的反应类型属于________(填序号)。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是_____________________________
(4)若经反应Ⅰ得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol·L-1 NaOH溶液完全吸收,则反应Ⅳ中生成FeSO4的离子方程式是_________________
氮元素可以形成多种分子和离子,如NH3、N2H4、N2-、NH4+、N2H62+等。回答以下问题:
(1)N的基态原子中,有_________个运动状态不同的未成对电子;
(2)某元素原子与N3-含有相同的电子数,其基态原子的价电子排布图是____________;
(3)NH3、N2H4、NH4+、N2H62+四种微粒中,同种微粒间能形成氢键的有_________;不能作为配位体的有_______;
(4)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因是_______;
(5)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①N2H4分子中氮原子的杂化类型是_________;
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)
若该反应中有4mol N-H键断裂,则形成的π键有_________mol;
(6)肼能与硫酸反应生成N2H6SO4.N2H6SO4化合物类型与硫酸铵相同,则N2H6SO4内微粒间作用力不存在_________(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是g)
求:
(1)加入NaOH溶液0--20mL过程中反应的离子方程式为____________________;沉淀中Al(OH)3的质量为____________g。
(2)合金中Mg的质量为___________;所用HCl的物质的量浓度为___________mol/L。
金属及其化合物在人类生产、生产中发挥着重要的作用。
(1)钠、铝、铁三种金属元素所形成的各种氧化物中具有强氧化性的是________(填化学式,下同);适宜做耐火材料的是_______________。
(2)若Na2CO3粉末中混有少量NaHCO3杂质,最适宜的除杂方法是________,反应的化学方程式___________。
(3)取少量FeCl2溶液,按如图所示操作,使其跟NaOH溶液反应.可观察到的实验现象是_____________。
(4)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是____________(填序号)。
| A.有铜无铁 | B.有铁无铜 | C.铁、铜都有 | D.铁、铜都无 |
榴石矿石可以看作由CaO、FeO、Fe2O3、Al2O3、SiO2组成。工业上对其进行综合利用的流程如下:
(1)溶液Ⅰ中除了Ca2+外,还可能含有的金属阳离子有__________________;
(2)步骤③中NaOH参加反应的离子方程式____________________________,鼓入空气并充分搅拌的目的是(用化学方程式表示)____________________;
(3)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是_____________________。
H1N1病毒是一种没有超常抵抗力的病毒。研究证明,许多常用消毒药物如漂粉精、漂白粉、高锰酸钾等,可以将H1N1病毒杀灭。
(1)工业上制取漂白粉的反应方程式为__________________________;
(2)将漂白粉溶于适量水中,呈白色浊状物,静置沉降.取少许上层清液,滴加碳酸钠溶液出现白色沉淀,写出其中反应的离子方程式____________________;另取少许上层清液,滴加适量的_____________(填化学式)即可检验Cl-的存在,发生反应的化学方程式为___________________;
(3)漂白粉在空气中长期放置,会失效,用化学方程式解释其原因_______________________。